
【题目】近年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的。
实验目的:通过实验证明煤中含有碳元素和硫元素。
查阅资料:
(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),请完成该反应的离子方程式:___。
( )SO2+( )MnO4-+( )=( )+( )Mn2++( )
根据上述资料,甲同学和丙同学分别设计实验方案进行探究。
实验探究:甲同学:甲同学进行了如图所示A、B两步实验:

“实验现象”:A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(2)乙同学认为甲的方案不合理,其理由是___:
实验探究:丙同学:丙同学进行了如图所示实验(部分装置在图中略去):

(3)图C装置的作用是___。
(4)证明煤中含有碳元素和硫元素的现象是:___。
(5)装置C中的高锰酸钾溶液也可以替换为___。
A.足量I2的淀粉溶液
B.足量饱和NaHCO3溶液
C.足量Na2SO3溶液
D.足量溴水
【答案】(5)SO2+(2)MnO4-+(2)H2O=(5)SO42-+(2)Mn2++(4)H+ SO2也能使澄清石灰水变浑浊,不能证明煤中含有碳元素 除去SO2并检验其是否除尽 B中褪色,C中不褪色,D中变浑浊 AD
【解析】
(1)SO2被MnO4-氧化为SO42-,根据得失电子守恒、电荷守恒配平离子方程式;
(2)SO2和氢氧化钙反应生成亚硫酸钙沉淀和水;
(3)在装置A中使煤充分燃烧,通过B稀酸性高锰酸钾溶液来检验SO2;通过C浓酸性高锰酸钾溶液来除去SO2,以确保完全除尽,再通过D澄清石灰水来检验CO2气体。
(1)SO2被MnO4-氧化为SO42-,S元素化合价由+4升高为+6、Mn元素化合价由+7降低为+2,根据得失电子守恒、电荷守恒配平离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(2)SO2和氢氧化钙反应生成亚硫酸钙沉淀和水,B中澄清石灰水变浑浊,不能证明煤中含有碳元素;
(3)SO2被MnO4-氧化为SO42-,装C用浓酸性高锰酸钾溶液来除去SO2,以确保完全除尽,防止干扰CO2的检验;
(4)SO2能使高锰酸钾褪色,证明煤中含有硫元素的现象是B中溶液褪色;CO2能使澄清石灰水变浑浊,证明含有碳元素的现象是C中不褪色,D中变浑浊;
(5)高锰酸钾溶液有强氧化性,可以把SO2氧化为硫酸。若用其它物质来代替,只要物质有强氧化性,可以与SO2发生氧化还原反应即可。
A.I2+SO2+2H2O=H2SO4+2HI,SO2能被吸收,I2与CO2不能发生反应,故选A;
B.NaHCO3+SO2= NaHSO3+CO2.虽然能除去SO2,但是能产生CO2,会影响CO2的检验,故不选B;
C.Na2SO3+SO2+2H2O=2NaHSO3,由于该溶液呈碱性,也能吸收CO2,所以会影响CO2的检验,故不选C;
D. Br2+SO2+2H2O=H2SO4+2HBr,SO2能被吸收,溴水与CO2不能发生反应,所以可以除去SO2中的CO2,故选D;
所以选AD。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 0.1 molL﹣1的KI溶液:Na+、Ag+、NO3﹣、SO42﹣
B. 使甲基橙变红色的溶液:NH4+、Cu2+、ClO﹣、Cl﹣
C. c(OH﹣)=0.1mol/L的溶液:Na+、K+、CO32﹣、ClO﹣
D. 0.1 molL﹣1的KMnO4溶液:Na+、K+、Cl﹣、SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的粗表,①~⑧分别表示元素周期表中对应位置的元素
① | |||||||||||||||||
⑧ | ③ | ⑤ | |||||||||||||||
② | ④ | ||||||||||||||||
⑥ | |||||||||||||||||
⑦ | |||||||||||||||||
(1)用电子式表示①与②形成化合物A 的过程:________
(2)已知⑥原子的最外层有2个电子,请画出⑥原子的结构示意图:______________
(3)含有④元素的某种18 电子的离子与H+及OH-均可发生反应,请写出该离子的电子式______
(4)元素③④⑤的简单气态氢化物的稳定性由强到弱的顺序是_________(用化学式表示),其沸点由高到低的顺序是_______ (用化学式表示)
(5)已知⑦的稳定化合态为+2 价,且⑦与③可按3:4 形成某化合物,该化合物具有较强氧化性, 可以与浓盐酸反应并释放出一种黄绿色的气体, 请写出该化学方程式:_________________
(6)①与③,①与④能形成18个电子的化合物,此两种化合物在溶液中发生反应的化学方程式为_________。
(7)⑧的一种氧化物为无色气体,在空气中能迅速变成红棕色。在一定条件下,2L的该无色气体与0.5 L 的氧气混合,该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则所生成的一种含氧酸盐的化学式是_________。
(8)两种均含①与②③④四种元素的化合物相互反应放出气体的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产生活中的许多现象或应用都与化学知识有关。下列现象或应用与胶体性质无关的是
A. 将盐卤或石膏加入豆浆中,制成豆腐
B. 冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷
C. 泡沫灭火器中将Al2(SO4)3与NaHCO3溶液混合后,喷出大量泡沫,起到灭火作用
D. 清晨,人们经常能看到阳光穿过茂密的树木枝叶所产生的美丽景象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置完成对应的实验,能达到实验目的的是
A. 制取并收集少量乙炔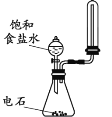
B. 制取并检验乙烯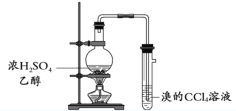
C. 检验溴乙烷与NaOH乙醇溶液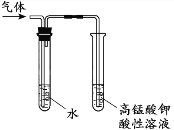
D. 制取并提纯乙酸乙酯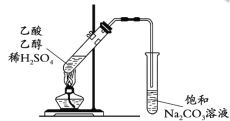
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型,高效、多功能绿色水处理剂,可通过KClO溶液与Fe(NO3)3溶液的反应制备。
已知:①KClO在较高温度下发生歧化反应生成KClO3
②K2FeO4具有下列性质:可溶于水、微溶于浓KOH溶液;在强碱性溶液中比较稳定;在Fe3+催化作用下发生分解,在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2,如图所示是实验室模拟工业制备KClO溶液装置。

(1)B装置的作用为______________________;
(2)反应时需将C装置置于冷水浴中,其原因为__________________;
(3)制备K2FeO4时,不能将碱性的KClO溶液滴加到Fe(NO3)3饱和溶液中,其原因是________,制备K2FeO4的离子方程式_________________;
(4)工业上常用废铁屑为原料制备Fe(NO3)3溶液,溶液中可能含有Fe2+,检验Fe2+所需试剂名称________,其反应原理为______________________(用离子方程式表示);
(5)向反应后的三颈瓶中加入饱和KOH溶液,析出K2FeO4固体,过滤、洗涤、干燥。洗涤操作所用最佳试剂为______________________;
A.水 B.无水乙醇 C.稀KOH溶液
(6)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如如图所示:

①消耗Na2S2O3标准溶液的体积为____________mL。
②原样品中高铁酸钾的质量分数为_________________。[M(K2FeO4)=198g/mol]
③若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数____________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通人BaCl2溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另种气体A,则产生白色沉淀。制备气体A的试剂不可能是( )
A.Cu和浓硝酸
B.NaOH和浓氨水
C.大理石和稀盐酸
D.MnO2和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3—、SO42—、CO32—,已知:
①五种盐均溶于水,水溶液均为无色;
②D的焰色反应呈黄色;
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性;
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀;
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失;
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀;
已知:向Ag+溶液中滴加氨水,先产生沉淀,继续滴加氨水,沉淀溶解。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是_____;所含阴离子相同的两种盐的化学式是________。
(2)D的化学式为____________,D溶液显碱性的原因是(用离子方程式表示)_____________。
(3)A和C的溶液反应的离子方程式是_______________;E和氨水反应的离子方程式是_______________。
(4)若要检验B中所含的阳离子,正确的实验方法是:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用只含有铝、铁、铜的工业合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,其实验方案如图所示:

(1)合金与NaOH溶液反应的离子方程式为_________________________________________。
(2)方案中途径②的离子方程式________________________________________________,
D中加入适量盐酸的离子方程式为________________________________________________。
(3)滤渣F的主要成分为____________________
(4)CuSO4溶液中获得胆矾的操作为蒸发浓缩,_____________、过滤_,洗涤、自然干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com