
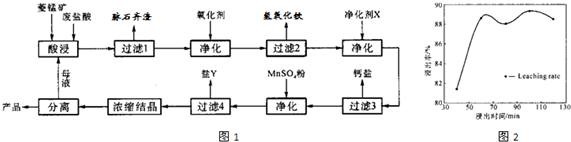
某种碳酸锰矿的主要成分有MnCO3 、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:

阴离子膜法电解装置如图所示:

(1)写出用稀硫酸溶解碳酸锰反应的离子方程式 。
(2)在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,请解释原因 .
(3)(5分)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:

加氨水调节溶液的pH等于6,则滤渣的成分是 ,滤液中含有的阳离子有H+和 。
(4)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为 。
(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资浪费,写出该副反应的电极反应式 。
(1)MnCO3+2H+=Mn2++CO2↑+H2O(2)MnO2在酸性条件下被二价铁还原为Mn2+(3)Al(OH)3、Fe(OH)3 ;Mn2+、Mg2+、NH4+(4)负极 4OH--4e-=O2↑+2H2O(5)Mn2++2H2O-2e-=MnO2+4H+
【解析】
试题分析:(1)碳酸盐遇到比碳酸酸性强的酸会溶解,在足量酸中生成CO2,故反应式MnCO3+2H+=Mn2++CO2↑+H2O(2)MnO2在酸性条件下被二价铁还原为Mn2+。溶液中Fe2+被MnO2氧化成Fe3+,使MnO2转化为Mn2+(3)由题可知Fe3+ Al3+ 沉淀沉淀完全的pH为3.7和4.7,生成沉淀Al(OH)3和Fe(OH)3,而Fe2+在氨水中与氧气也缓慢氧化为Fe(OH)3,而滤液中的阳离子为H+、Mn2+、Mg2+、NH4+(4)电解溶液中阴离子向阳极移动,故A电极为负极;电解池中阳极吸引阴离子,发生氧化反应化合价升高,故阳极电极反应式为4OH--4e-=O2↑+2H2O;(5)阳极发生氧化反应,故Mn2++2H2O-2e-=MnO2+4H+
考点:电解原理的应用实验;氧化还原反应的配平


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ① | ② |
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期中考试化学试卷(解析版) 题型:填空题
(9分)某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:

阴离子膜法电解装置如下图所示:

(1)写出用稀硫酸溶解碳酸锰反应的离子方程式: 。
(2)已知Ksp
(Fe(OH)3) = 4 ´10–38,假设溶液中Fe3+离子浓度为0.1 mol·L–1,则开始生成Fe(OH)3
沉淀的pH是_________,沉淀完全的pH是_________。(可能用到的数据:lg =
-0.1 lg
=
-0.1 lg =0.2)
=0.2)
(3)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
|
离子 |
Fe3+ |
A13+ |
Fe2+ |
Mn2+ |
Mg2+ |
|
开始沉淀的pH |
1.2 |
3.7 |
7.0 |
7.8 |
9.3 |
|
沉淀完全的pH |
3.7 |
4.7 |
9.6 |
9.8 |
10.8 |
加氨水调节溶液的pH等于6,则“滤渣(待处理)”的成分是 (写化学式),滤液中含有的阳离子有H+和 (写符号)。
(4)在浸出液里锰元素只以Mn2+的形式存在,且滤渣A中也无MnO2,请用离子方程式解释原因: 。
(5)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为 。
(6)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com