
【题目】a mL三种气态烃组成的混合物与足量氧气混合,点燃爆炸后,恢复到原来的状态(常温、常压),体积共缩小2a mL。则三种烃可能是( )
A.C2H4、C2H2、CH4B.C2H6、C3H6、C4H6
C.CH4、C2H6、C3H8D.CH4、C2H4、C3H4
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示。下列说法正确是

A. 有MnO2条件下的反应曲线是a曲线
B. a曲线变为b曲线,反应的活化分子百分数增大
C. a曲线变为b曲线,平衡时H2O2的转化率增大
D. b曲线的热化学方程式为:H2O2(l) =H2O(l) +1/2O2(g) ΔH= - ( E1 - E2)KJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2。在500℃下发生发应,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
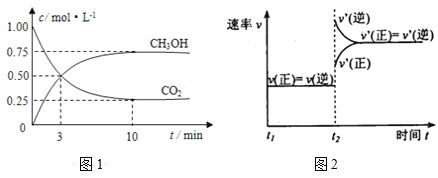
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=________。
(2)500℃该反应的平衡常数为_____(结果保留一位小数),图2是改变温度时化学反应速率随时间变化的示意图,若提高温度到800℃进行,达平衡时,K值_____(填“增大”“减小”或“不变”)。
(3)下列措施中不能使CO2的转化率增大的是_______。
A 在原容器中再充入1mol H2 B 在原容器中再充入1molCO2
C 缩小容器的容积 D 使用更有效的催化剂 E 将水蒸气从体系中分离出
(4)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正)____ v(逆)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“太阳水”电池装置如图所示,该电池由三个电极组成,其中 a 为TiO2电极,b 为Pt 电极,c 为 WO3 电极,电解质溶液为 pH=3 的 Li2SO4-H2SO4 溶液。锂离子交换膜将电池分为 A、B 两个区,A 区与大气相通,B 区为封闭体系并有 N2 保护。下列关于该电池的说法错误的是
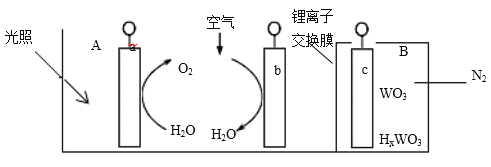
A.若用导线连接a、c,则 a 为负极,该电极附近 pH 减小
B.若用导线连接 a、c,则 c 电极的电极反应式为HxWO3-xe-=WO3+ xH+
C.若用导线连接 b、c,b 电极的电极反应式为 O2+4H++4e-=2H2O
D.利用该装置,可实现太阳能向电能转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)铁元素在周期表中的位置为_________,基态Fe3+ 核外电子排布式为_________。
(2)在[Fe(CN)6]3- 中不存在的化学键有_________。
A. 离子键 B.金属键 C.氢键 D. 共价键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2O KCN+HCl=HCN+KCl HC≡CH+HCN→H2C=CH-C≡N
①KCNO中各元素原子的第一电离能由小到大排序为________。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是_______;分子中σ键和π键数目之比为_______。
(4)C22-和N2互为等电子体,CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为_______。
(5)金属Fe能与CO形成Fe(CO)5,该化合物熔点为-20℃,沸点为103℃,则其固体属于_______晶体。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为_________nm(用含有d、NA的代数式表示)。
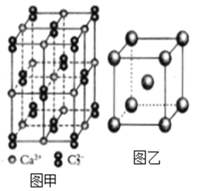
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是 ( )
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 与![]() 互为同分异构体的芳香族化合物有6种
互为同分异构体的芳香族化合物有6种
C. 含有5个碳原子的某饱和链烃,其一氯取代物可能有3种
D. 菲的结构简式为![]() ,它与硝酸反应,可生成 5种一硝基取代物
,它与硝酸反应,可生成 5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个1L 的密闭容器中,X、Y、Z 三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:
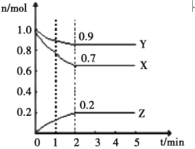
(1)2min时,Y 的物质的量浓度是____________;
(2)从开始至2min,X 的平均反应速率为_________;
(3)该反应的化学方程式为____________________;
(4)1min时,v(正)____v(逆),2min时,v(正)____v(逆) (填“>”或“<”或“=”);
(5)在2min时,向容器中通入氩气,增大体系压强,X 的化学反应速率将______;
(6)2min时,x的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某样品中氟元素的质量分数进行如下实验,利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(氢氟酸为低沸点酸,含量低,不考虑对玻璃仪器的腐蚀),用水蒸气蒸出,再通过滴定测量。实验装置如下图所示,加热装置省略。
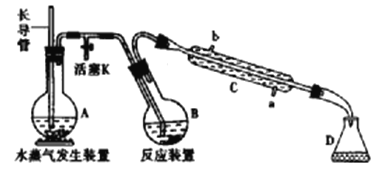
(1)A的名称是___________,长导管用于平衡压强,实验过程中其下端___________(填“能”或“不能”)在液面以上。
(2)仪器C是直形冷凝管,实验过程中,冷却水应从___________口出。(填“a”或“b")
(3)实验时,首先打开活塞K,待水沸腾时,关闭活塞K,开始蒸馏:若蒸馏时因反应装置局部堵塞造成长导管水位急剧上升,应立即______________________。
(4)连接水蒸气发生装置和反应装置之间的玻璃管常裹以石棉绳,其作用是___________。
(5)B中加入一定体积高氯酸和1.00g氟化稀土矿样,D中盛有滴加酚酞的NaOH溶液。加热A、B,使A中产生的水蒸气进入B。
①下列物质不可代替高氯酸的是___________(填标号)
a.醋酸 b.硝酸 c.磷酸 d.硫酸
②D中主要反应的离子方程式为_________________________________。
(6)向馏出液中加入25.00mL0.100mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用0.100 mol·L -1EDTA标准溶液滴定剩余La3+(La3+与EDTA按1︰1络合),消耗EDTA标准溶液20.00mL,则氟化稀土样品中氟的质量分数为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com