
| A. | 乙烷和己烷 | B. | CH3COOH、C3H6O2 | C. | 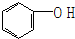 和 和 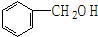 | D. | HCHO、CH3COOH |
 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 1L0.1/L KAl(SO4)2溶液中含有Al3+离子数为0.1NA | |
| B. | 标准状况下,11.2L氦气含有分子数0.5NA | |
| C. | 1mol乙烷分子中含有7NA个共价键 | |
| D. | 32g硫与足量的铜反应,转移电子数2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
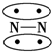 ,CO的结构可以表示为
,CO的结构可以表示为 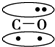 ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )| A. | N2分子与CO分子中都含有三键 | B. | CO分子中有一个π键是配位键 | ||
| C. | N2与CO互为等电子体 | D. | N2与CO的化学性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,6.4 g O2和O3的混合气体中含有的分子数为0.4NA | |
| B. | 0.1 mol Fe与少量氯气反应生成FeCl2,转移电子数为0.2 NA | |
| C. | 1.4 g由乙烯和环丙烷组成的混合物中含有原子的数目为 0.3 NA | |
| D. | 0.1 mol•L-1碳酸钠溶液中含有CO32-离子数目小于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
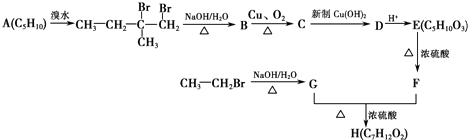
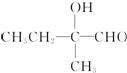 +2Cu(OH)2+OH-$\frac{\underline{\;\;△\;\;}}{\;}$
+2Cu(OH)2+OH-$\frac{\underline{\;\;△\;\;}}{\;}$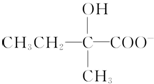 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.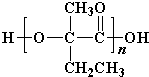 .
.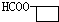 、
、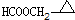 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
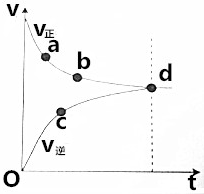
| A. | 起始只投入Fe(CO)5 | |
| B. | d点表示该反应达到限度 | |
| C. | 到达d点后,CO的浓度不变 | |
| D. | 反应过程中,CO的正反应速率逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 人们对苯及芳香烃的认识是一个不断深化的过程.
人们对苯及芳香烃的认识是一个不断深化的过程. .
.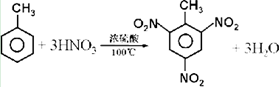 .
.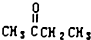 )、丙酮和琥珀酸(HOOC-CH2CH2-COOH)的混合物,该烃的结构简式是CH3CH2C(CH3)=CHCH2CH2CH=C(CH3)2.
)、丙酮和琥珀酸(HOOC-CH2CH2-COOH)的混合物,该烃的结构简式是CH3CH2C(CH3)=CHCH2CH2CH=C(CH3)2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com