
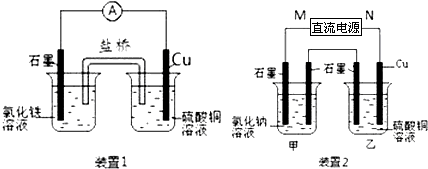
| ||
| ||
| 0.112L |
| 22.4L/mol |
| ||
| 0.01mol |
| 0.1L |


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量二氧化碳通入水玻璃中:CO2+SiO32-+H2O═CO32-+H2SiO3↓ |
| B、钠投入水中:Na+H2O═Na++OH-+H2↑ |
| C、AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
| D、氯气通入水中:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

| 改变的反应条件 | 反应速率改变的结果 |
| 降低反应体系的温度 | |
| 将容器的体积改为1L | |
| 使用催化剂 | |
| 保持容器体积不变,充入一定量氦气,增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在铜与硫的反应中,1mol铜失去的电子数为NA |
| B、标准状况下,11.2LSO3所含硫原子数为0.5NA |
| C、由2H和18O所组成的水11g,其中所含的中子数为4NA |
| D、1molCl2与足量的水反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuSO4?3H2O |
| B、CuSO4?H2O |
| C、CuSO4 |
| D、CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、①③ |
| C、②④ | D、①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com