
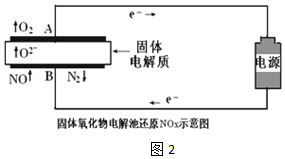
| 实验序号 | B极气体 | 电路中通过电子 | 消耗总电能 | 生成N2 |
| 实验1 | NO | 1mol | a KJ | 0.25mol |
| 实验2 | NO和空气 (不考虑NO2) | 1mol | a KJ | 0.09mol |
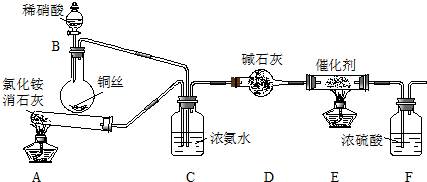
分析 (1)用A装置制取氨气,B装置制取氮氧化物,C装置中氨气和氮氧化物充分混合均匀,通过D干燥气体,E装置中氮氧化物和氨气在催化剂、加热条件下反应生成氮气,浓硫酸具有酸性和吸水性,能吸收碱性气体和水蒸气;
①在加热条件下,氯化铵和氢氧化钙反应生成氨气;
②碱石灰具有吸水性;
(2)①当NOx被Na2CO3溶液完全吸收时,则n(NO2)≥n(NO);
②利用差量法计算NO、NO2的物质的量,再根据平均摩尔质量法计算x值;
(3)①生成0.25mol氮气放出的热量为0.8akJ,则生成1mol氮气放出的热量为3.2kJ,据此书写热化学方程式;
②氧气或二氧化氮分解需要消耗能量.
解答 解:(1)用A装置制取氨气,B装置制取氮氧化物,C装置中氨气和氮氧化物充分混合均匀,通过D干燥气体,E装置中氮氧化物和氨气在催化剂、加热条件下反应生成氮气,浓硫酸具有酸性和吸水性,能吸收碱性气体和水蒸气;
①在加热条件下,氯化铵和氢氧化钙反应生成氨气,反应方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②碱石灰具有吸水性,所以D装置作用是除去气体中含有的水蒸气,故答案为:除去气体中含有的水蒸气;(2)①当NOx被Na2CO3溶液完全吸收时,则n(NO2)≥n(NO),当n(NO2):n(NO)=1时x值最小,x最小值为$\frac{2+1}{2}$=1.5,因为混有NO,所以x最大值<2,故x的取值范围为1.5≤x<2,所以x的值不可能是1.3,故选D;
②设由NO2和纯碱反应产生CO2为amol,
由NO和NO2与纯碱反应产生的CO2为bmol,
2NO2+Na2CO3=NaNO2+NaNO3+CO2 质量增加
1mol△m=48g
amol 48ag
NO+NO2+Na2CO3=2NaNO2+CO2 质量增加
1mol△m=32g
bmol 32bg,
$\left\{\begin{array}{l}{a+b=1}\\{48a+32b=44}\end{array}\right.$
解得a=0.75mol,b=0.25mol,
n(NO2)=0.75mol×2+0.25mol=1.75mol
n(NO)=0.25mol
x=$\frac{0.25mol×1+1.75mol×2}{0.25mol+1.75mol}$=1.875,
故答案为:1.875;
(3)①生成0.25mol氮气放出的热量为0.8akJ,则生成1mol氮气放出的热量为3.2kJ,所以其热化学方程式为:2NO(g)=N2(g)+O2(g)△H=+3.2akJ/mol,
故答案为:2NO(g)=N2(g)+O2(g)△H=+3.2akJ/mol;
②氧气或二氧化氮分解需要消耗能量,导致消耗相同的能量时生成氮气的物质的量较少,电极反应式为:O2+4e-=2O 2-或2NO2+8e-=4O2-+N2,
故答案为:O2+4e-=2O 2-或2NO2+8e-=4O2-+N2.
点评 本题以氮氧化物为载体考查了物质间的反应,明确物质的性质是解本题关键,难点是(2)题的计算及(3)题电极反应式的书写,注意原子守恒的灵活运用,题目难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | N-H | N-N | N≡N | O-H |
| 键能(kJ.mol-1) | 390 | 190 | 946 | 460 |

| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
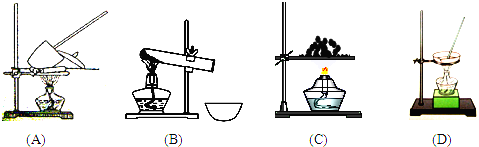
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com