
【题目】已知NA为阿伏加德罗常数的值,下列说法正确的是
A.3g由CO2和SO2组成的混合气体中含有的质子数为1.5NA
B.1L0.1molL-1 Na2SiO3溶液中含有的SiO32-数目为0.1NA
C.0.1molH2O2分解产生O2时,转移的电子数为0.2NA
D.2.8g聚乙烯中含有的碳碳双键数目为0.1NA
【答案】A
【解析】
A. 假设3g由CO2和SO2组成的混合气体中CO2的质量为xg,有CO2含有的质子的物质的量为![]() ,SO2含有的质子的物质的量为
,SO2含有的质子的物质的量为![]() ,电子的总物质的量为
,电子的总物质的量为![]() ,因此3g由CO2和SO2组成的混合气体中含有的质子数为1.5NA,A项正确;
,因此3g由CO2和SO2组成的混合气体中含有的质子数为1.5NA,A项正确;
B. 由于SiO32-会水解,因此1L0.1molL-1 Na2SiO3溶液中含有的SiO32-数目小于0.1NA,B项错误;
C. 1mol过氧化氢分解转移的电子的物质的量为1mol,因此0.1molH2O2分解产生O2时,转移的电子数为0.1NA,C项错误;
D. 聚乙烯中不存在碳碳双键,因此2.8g聚乙烯中含有的碳碳双键数目为0,D项错误。
故答案选A。


科目:高中化学 来源: 题型:
【题目】用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、NiO、SiO2等)制备草酸钴晶体(CoC2O4·2H2O)的流程如图:
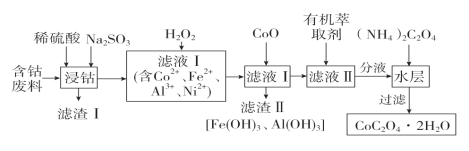
(1)滤渣Ⅰ的成分是________;浸钴时Al2O3溶解的离子方程式为__________________;Co2O3溶解的离子方程式为________________________________。
(2)滤液Ⅰ加入H2O2的目的是________________________________________;加入CoO产生Fe(OH)3和Al(OH)3的原因是_________________________________________;若要将滤液Ⅰ中Fe3+和Al3+全部沉淀,则应将滤液Ⅰ的pH控制在_____________。(已知:溶液中离子浓度小于1×10-5 mol·L-1,则认为离子完全沉淀;Ni(OH)2、Fe(OH)3、Al(OH)3的Ksp分别为1×10-15、1×10-38、1×10-32)
(3)加入有机萃取剂的目的是_______________________________。
(4)加入(NH4)2C2O4反应的离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬[(CH3COO)2Cr·H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是_________,仪器a的名称是_______。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_________。
②同时c中有气体产生,该气体的作用是_____________。
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是________;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是___________、_________、洗涤、干燥。
(4)指出装置d可能存在的缺点______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用饱和硫酸亚铁、浓硫酸和硝酸钾反应可以制得纯度为98%的NO,其反应为FeSO4+KNO3+H2SO4(浓)![]() Fe2(SO4)3+NO↑+K2SO4+H2O(未配平)。下列有关说法不正确的是
Fe2(SO4)3+NO↑+K2SO4+H2O(未配平)。下列有关说法不正确的是
A. 该反应的氧化剂是KNO3
B. 氧化产物与还原产物的物质的量之比为2∶3
C. Fe2(SO4)3、K2SO4、H2O均为电解质
D. 该反应中生成144gH2O,转移电子的物质的量为12mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
(3)H2(g) +![]() O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( )
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请写出NaHCO3在水中的电离方程式:______________;NaOH溶液与NaHCO3溶液反应的离子方程式:________________。
(2)某无色透明溶液中可能大量存在NH4+、Na+、Ba2+、Fe3+、CO32-、SO42-、Cl-中的几种离子。从其中取两份各100mL溶液,进行如下实验:
①根据溶液颜色可以判断溶液中不存在的离子是_____________;
②取其中的一份溶液进行实验,加入过量氢氧化钠浓溶液并加热,共生成448mL气体(标准状况下),有关的离子方程式为______________;
③取另一份溶液加入过量Ba(NO3)2溶液,生成3.94g白色沉淀,过滤,向沉淀中再加入足量稀盐酸,沉淀全部溶解;根据以上实验结果确定:原溶液中肯定存在的离子有___________;请你设计实验方案证明该溶液中是否含有Cl-?_____________ 。
(3)某氮肥厂的氨氮废水中氮元素多以NH4+和NH3·H2O的形式存在。该厂的技术团队设计该废水处理方案流程如下:
![]()
①过程Ⅱ:在微生物的作用下实现NH4+→NO2-→NO3-转化,称为硝化过程。在碱性条件下,NH4+被氧气(O2)氧化成NO3-的总反应的离子方程式为________________。
②过程Ⅲ:在一定条件下向废水中加入甲醇(CH3OH),实现HNO3→NO2-→N2转化,称为反硝化过程。反硝化过程中甲醇(C元素为-2价)转化为CO2,若有6molHNO3完全转化成N2,消耗的甲醇的物质的量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
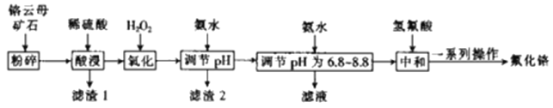
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如下。
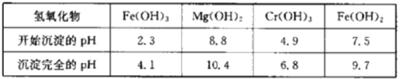
下表列出了相关金属离子生成氢氧化物沉淀的pH:
请回答下列问题:
(1)Fe2O3、MgO、FeO、SiO2中属于碱性氧化物的有___种。
(2)将铬云母矿石粉碎的目的是___。
(3)滤渣1主要成分的用途是___。(写一种)
(4)Cr2O3与稀硫酸反应的化学方程式为___。
(5)第一次滴加氨水调节pH范围为___。
(6)第二次滴加氨水调节pH为6.8~8.8的目的是___,Cr(OH)3与Al(OH)3一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置(夹持装置略)制取和收集纯净、干燥的氨气,并探究氨气的性质。
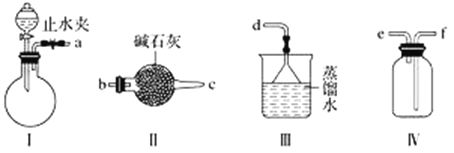
(1)关闭装置Ⅰ中的止水夹,向分液漏斗中加适量水,打开活塞,说明Ⅰ气密性良好的现象是______________________。
(2)利用装置Ⅰ制取氨气,不能选用的试剂为浓氨水和________(填字母)。
A.氢氧化钠 B.碱石灰 C.硝酸钾 D.生石灰
(3)根据实验要求,仪器连接的顺序(用字母编号表示):a接________、________接________、______接______。______
(4)收集氨气,按如图装置进行NH3性质的探究实验。
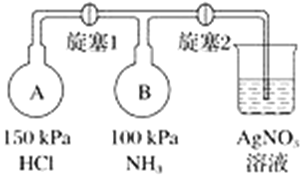
①打开旋塞1,B瓶中的现象是_________________________________________,原因是_____________________________________________,稳定后,关闭旋塞1;
②再打开旋塞2,B瓶中的现象是__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com