
| A. | S(s)+O2(g)=SO2(g),反应放出的热量大于293.23 kJ•mol-1 | |
| B. | S(g)+O2(g)=SO2(g),反应放出的热量小于293.23 kJ•mol-1 | |
| C. | 1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和 | |
| D. | 1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和 |
分析 根据物质由液态转变成固态要放出热量,由液态转变成气态要吸收热量以及放热反应中旧键断裂吸收的能量小于新键形成所放出的能量来分析.
解答 解:A、因物质由液态转变成固态要放出热量,所以S(s)+O2(g)=SO2(g)反应放出的热量小于297.23kJ•mol-1,故A错误;
B、因物质由液态转变成气态要吸收热量,所以S(g)+O2(g)=SO2(g)的反应热的数值大于297.23kJ•mol-1,故B错误;
C、因放热反应中旧键断裂吸收的能量小于新键形成所放出的能量,1molSO2的键能总和大于1molS和1molO2的键能总和,故C错误;
D、因放热反应中旧键断裂吸收的能量小于新键形成所放出的能量,1molSO2的键能总和大于1molS和1molO2的键能总和,故D正确;
故选D.
点评 本题主要考查了化学反应中反应热的计算,需要注意的是物质三态之间的转变也存在能量的变化.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 投料比 CO体积分数/% 温度/℃ | $\frac{n{H}_{2}O}{n(CO)}$=1 | $\frac{n{H}_{2}O}{n(CO)}$=3 | $\frac{n{H}_{2}O}{n(CO)}$=5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的相对原子质量呈周期性变化 | |
| B. | 元素的原子半径呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素原子的核外电子排布呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
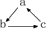 关系相互转化的是(“→”表示一步完成)( )
关系相互转化的是(“→”表示一步完成)( )| 选项 | A | B | C | D |
| a | SiO2 | NaOH | HNO3 | Cu |
| b | Na2SiO3 | Na2CO3 | NO | CuSO4 |
| c | H2SiO3 | NaHCO3 | NO2 | Cu(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某原子K层上只有一个电子 | |
| B. | 某原子M层上电子数为L层电子数的4倍 | |
| C. | 某离子M层上的电子数为K层的4倍 | |
| D. | 阴离子的最外层电子数可能为2,也可能为8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0 | B. | 2.3 | C. | 3.0 | D. | 7.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④⑤ | B. | 只有①③④ | C. | ①②③④⑤ | D. | 只有①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com