
| A. | Fe | B. | Mg | C. | P | D. | Na |
分析 电子最后填入的能级是p能级的元素属于P区元素,P区元素的外围电子排布为ns2npx,包含第ⅢA~ⅦA族及零族元素,电子最后填入的能级是s能级的元素属于s区元素(注意氦元素除外),包括ⅠA、ⅡA族元素,电子最后填入的能级是d能级的元素属于d区元素,包括ⅢB~ⅦB及Ⅷ族,ds区包括ⅠB族(11列)、ⅡB族(12列),可以理解为先填d能级后填s能级而得名,此外还有f区,包含镧系、锕系,以此来解答.
解答 解:A.Fe的外围电子排布为3d64s2,属于d区元素,故A不符合;
B.Mg的外围电子排布为3s2,属于s区元素,故B不符合;
C.P的外围电子排布为3s23p4,所以为p区元素,故C符合;
D.Na的外围电子排布为3s1,所以属于s区,故D不符合;
故选C.
点评 本题考查元素原子结构与位置关系,为高频考点,把握元素的电子排布及最后填充的电子为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 碘化氢的生成速率大于其分解速率 | B. | 碘化氢的生成速率等于其分解速率 | ||
| C. | 加催化剂不会影响达到平衡的时间 | D. | 升高温度可以加快平衡状态的到达 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①②⑤ | C. | ②⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②④ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液与盐酸:CO32-+2 H+=H2O+CO2↑ | |
| B. | 硝酸银溶液与铜:Cu+Ag+=Cu2++Ag | |
| C. | 金属钾与水反应:K+H2O═K++OH-+H2↑ | |
| D. | 用醋酸除水垢:2CH3COOH+CaCO3=Ca2++2CH3COO-+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
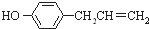 )是植物挥发油中的一种成分,1mol胡椒酚最多可与a mol H2发生反应、最多可与b mol Br2在水溶液中发生反应,则a、b分别是( )
)是植物挥发油中的一种成分,1mol胡椒酚最多可与a mol H2发生反应、最多可与b mol Br2在水溶液中发生反应,则a、b分别是( )| A. | 4 3 | B. | 4 2 | C. | 3 3 | D. | 3 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
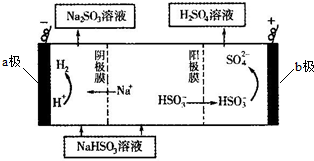
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
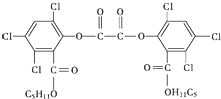 “魔棒”常被用于晚会现场气氛的渲染.“魔棒”发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列说法中正确的是( )
“魔棒”常被用于晚会现场气氛的渲染.“魔棒”发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列说法中正确的是( )| A. | CPPO难溶于水 | |
| B. | CPPO属于芳香烃也属于高分子化合物 | |
| C. | 1 mol CPPO与氢气完全反应,需要10 mol H2 | |
| D. | 1 mol CPPO与NaOH稀溶液反应(不考虑苯环上氯原子水解),最多消耗4 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
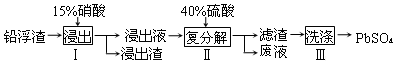
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com