


 10Al(OH)3+3N2↑+6OH-(3分)
10Al(OH)3+3N2↑+6OH-(3分) ⑵引入的Ca2+对人体无害(1分)来源丰富、价格便宜(1分) 铝(1分)
⑵引入的Ca2+对人体无害(1分)来源丰富、价格便宜(1分) 铝(1分)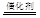 N2+4H2O+2OH-(3分)
N2+4H2O+2OH-(3分) 2H+(aq)+NO3- (aq)+H2O(l) △H=-346 kJ·mol-1(3分)
2H+(aq)+NO3- (aq)+H2O(l) △H=-346 kJ·mol-1(3分)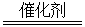 N2+4H2O+2OH-,
N2+4H2O+2OH-,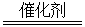 N2+4H2O+2OH-;
N2+4H2O+2OH-;

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
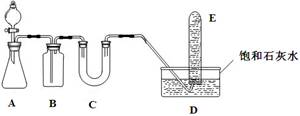
|
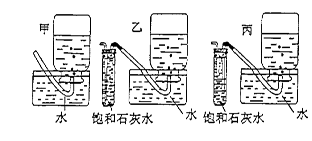
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
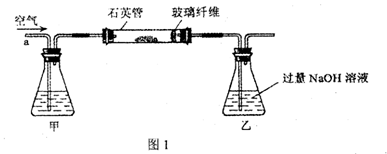
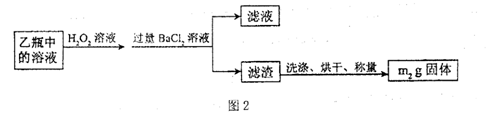
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将水加入浓硫酸中得到稀硫酸,置镁片于其中探究讨Mg的活泼性 |
| B.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 |
| C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 |
| D.将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgC12固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
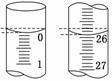
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
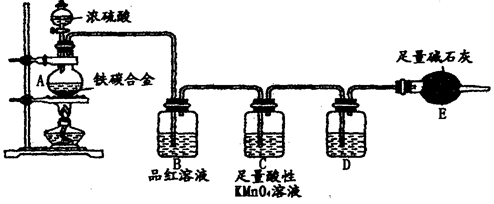

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
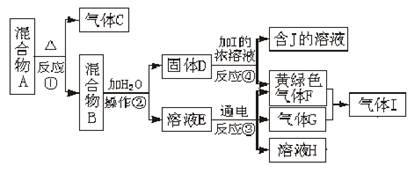
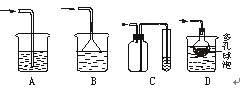
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com