
| A. | a:(b+c+d)=1:1.5 | B. | (a+b):(c+d)=1:1 | C. | a=b=c=d=1.12L | D. | a+b+c=d=0.2mol |
分析 氢氧化钙和二氧化碳反应生成碳酸钙沉淀,碳酸钙沉淀会继续和二氧化碳反应生成碳酸氢钙,反应方程式为:Ca(OH)2+CO2=CaCO3↓+H2O 和CaCO3+CO2+H2O=Ca(HCO3)2,而7.4g Ca(OH)2的物质的量为0.1mol,生成沉淀最大量为0.1mol,消耗二氧化碳为0.1mol,沉淀的质量为10g,所以a=b=0.05mol,而再通入cmol CO2还剩5g沉淀,消耗二氧化碳为0.05mol,再通入dmol CO2,沉淀恰好溶解得澄清溶液,消耗二氧化碳为0.05mol,所以a=b=c=d=0.05mol,由此分析解答.
解答 解:氢氧化钙和二氧化碳反应生成碳酸钙沉淀,碳酸钙沉淀会继续和二氧化碳反应生成碳酸氢钙,反应方程式为:Ca(OH)2+CO2=CaCO3↓+H2O 和CaCO3+CO2+H2O=Ca(HCO3)2,而7.4g Ca(OH)2的物质的量为0.1mol,生成沉淀最大量为0.1mol,消耗二氧化碳为0.1mol,沉淀的质量为10g,所以a=b=0.05mol,而再通入cmol CO2还剩5g沉淀,消耗二氧化碳为0.05mol,再通入dmol CO2,沉淀恰好溶解得澄清溶液,消耗二氧化碳为0.05mol,所以a=b=c=d=0.05mol,
A、a:(b+c+d)=0.05:0.05×3=1:3,故A错误;
B、(a+b):(c+d)=(0.05+0.05):(0.05+0.05)=1:1,故B正确;
C、状况不知,所以不一定为1.12L,故C错误;
D、a+b+c=0.15mol,而d=0.05mol,故D错误;
故选B.
点评 本题考查了氢氧化钙和二氧化碳反应的计算,中等难度,明确反应原理是解题关键.


科目:高中化学 来源: 题型:解答题
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
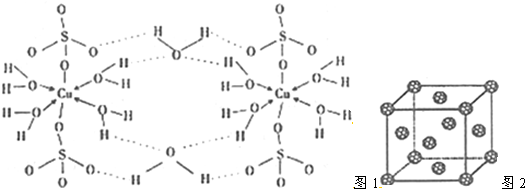
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯的结构简式: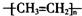 | B. | CH4分子的填充(或比例)模型: | ||
| C. | 乙醇的分子式:CH3CH2OH | D. | 8个中子的碳原子的核素符号:12C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
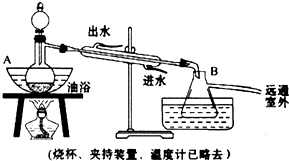 后静置,放出水层(废液).
后静置,放出水层(废液).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
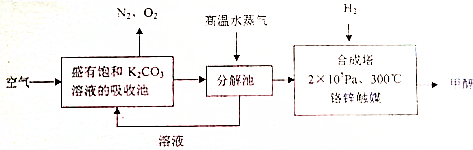
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
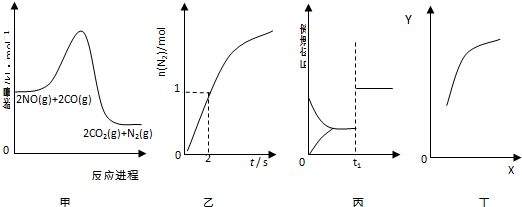
| A. | 由图象甲可知,该反应正反应为放热反应 | |
| B. | 由图象乙可知,0~2s内平均速率V(CO)=1mol•L-1•s-1 | |
| C. | 由图象丙可知,t1时改变的条件可能为增大压强 | |
| D. | 由图象丁中,若X为c(CO),则纵坐标Y可能为NO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏法 | B. | 水洗法 | C. | 分液法 | D. | 过滤法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;该化合物的晶体类型离子晶体
;该化合物的晶体类型离子晶体查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com