
| A. | 不溶于水的盐(CaCO3、BaSO4等)都是弱电解质 | |
| B. | 0.5 mol•L-1的所有一元酸中氢离子浓度都是0.5 mol/L | |
| C. | 强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度 | |
| D. | 电解质溶液导电的原因是溶液中有自由移动的阴阳离子 |
分析 A.电解质的强弱与溶解性无关;
B.不是所有的一元酸均能完全电离,如醋酸是弱酸,只部分电离;
C.H+浓度与酸的浓度、分子中氢离子的个数以及电离程度有关,与电解质的强弱无关;
D.溶液中带电离子能传递电荷.
解答 解:A.电解质的强弱与溶解性无关,不溶于水的盐可能是强电解质,CaCO3、BaSO4均是强电解质,故A错误;
B.不是所有的一元酸均能完全电离,如醋酸是弱酸,只部分电离,则0.5 mol•L-1一元弱酸中氢离子浓度小于0.5 mol/L,故B错误;
C.强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度,H+浓度与酸的浓度、分子中氢离子的个数以及电离程度有关,与电解质的强弱无关,如浓度非常小的强酸溶液中氢离子浓度也很小,故C错误;
D.溶液中带电离子能传递电荷,所以电解质溶液导电的原因是溶液中有自由移动的阴阳离子,故D正确.
故选D.
点评 本题主要考查的是强弱电解质的概念以及判断,涉及溶液导电的原因、溶液中离子浓度大小比较等,难度不大,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
 298K时,向体积均为15mL、浓度均为1.00mol•L-1的氨水和NaHCO3溶液中分别滴加l.00mol•L-1的盐酸,溶液的pH与所加盐酸体积的关系如图所示.下列有关叙述正确的是( )
298K时,向体积均为15mL、浓度均为1.00mol•L-1的氨水和NaHCO3溶液中分别滴加l.00mol•L-1的盐酸,溶液的pH与所加盐酸体积的关系如图所示.下列有关叙述正确的是( )| A. | 当V(盐酸)=4.00mL时,c(HCO3-)>c(NH4+)>c(CO32-) | |
| B. | 两个滴定过程均可选择酚酞作指示剂 | |
| C. | 曲线a是NaHCO3溶液的滴定曲线 | |
| D. | 当V(盐酸)=15.00mL时,c(Na+)═c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下0.1mol•L-1醋酸溶液稀释1000倍,测得pH约为5 | |
| B. | 用同浓度的NaOH溶液中和相同体积、相同pH的盐酸和醋酸溶液,比较消耗碱液体积的大小 | |
| C. | 醋酸钠溶液中加入酚酞试液后变红 | |
| D. | 0.01mol•L-1的CH3COOH溶液导电性实验中灯泡较暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气和液氯是两种不同的物质 | |
| B. | NH3是电解质,所以氨水能导电 | |
| C. | 氨不能用浓硫酸干燥,但可以用无水CaCl2干燥 | |
| D. | 新制的氯水呈酸性,向其中滴加几滴紫色石蕊试液并振荡,溶液先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KIO3和NaCl为离子化合物,均只含离子健 | |
| B. | KIO3中阳离子的结构示意图为 | |
| C. | KIO3只有氧化性,无还原性 | |
| D. | 23Na37Cl中质子数和中子数之比是7:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
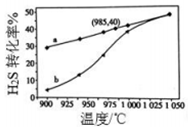 废气中的H2S通过高温热分解可制取氢气:2H2S(g)?2H2(g)+S2(g).在3L密闭容器中,控制不同温度进行H2S分解实验.
废气中的H2S通过高温热分解可制取氢气:2H2S(g)?2H2(g)+S2(g).在3L密闭容器中,控制不同温度进行H2S分解实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol | B. | 0.2 mol | C. | 0.05 mol | D. | 0.4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | AgCl | AgI | Ag2S |
| 颜色 | 白 | 黄 | 黑 |
| Ksp(25℃) | 1.8×10-10 | 8.3×10-17 | 5.3×10-50 |
| A. | 达到沉淀溶解平衡时,难溶电解质不再溶解 | |
| B. | 25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同 | |
| C. | 若先加入足量Na2S溶液,再加入KI溶液,则无黄色沉淀产生 | |
| D. | 25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com