
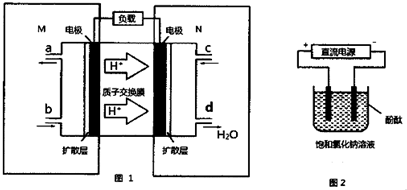
分析 (1)①首先根据氢离子的移动方向来确定正负极,然后根据原电池原理,最后书写电极反应式;
②整个电路中转移电子的数目相等,可以根据电子转移的数目相同来列出已知物质和未知物质之间关系式,然后通过关系来求解;
(2)应用盖斯定律解题,始终抓住目标反应和已知反应之间的关系应用数学知识来解.
解答 解:(1)①M区是质子流出的一极,应是原电池的负极,发生氧化反应,电极反应式为:CH3OH-6e-+H2O=CO2+6H+,故答案为:CH3OH-6e-+H2O=CO2+6H+;
②用惰性电极,电解饱和食盐水总的电极反应式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ H2↑+Cl2↑+2 OH-,pH值变为13时,pOH=1,C(OH-)=10-1mol/L,n(OH-)=10-1mol/L×300mL×10-3L/mL=0.03mol,由方程式CH3OH-6e-+H2O=CO2+6H+,2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ H2↑+Cl2↑+2 OH-
可知 CH3OH~6e-~6OH-
32g 6mol
m(CH3OH) 0.03mol
则m(CH3OH)=32g×0.03mol÷6mol=0.16g,
故答案为:0.16g;
(2)应用盖斯定律解题,△H=-△H1-△H2+$\frac{3}{2}$△H3+2△H4=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1,所以CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1,故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1.
点评 本题考查了电极反应式的书写,以及盖斯定律的应用,综合性强,但难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氧化铜(铜) | B. | 碳酸钙(氯化银) | C. | 氢氧化铁(氯化铁) | D. | 氢氧化钠(氯化钠) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中键的极性越强,分子越稳定 | |
| B. | 分子中共价键的键能越大,该物质的性质越不活泼 | |
| C. | 分子中共价键的键能越大,键越长,则分子越稳定 | |
| D. | 若把H2S写成H3S,违背了共价键的饱和性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | H | J | |||
| 3 | B | C | F | I |
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )
某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )| A. | 加等量的水后硫酸中水电离出的C(H+)与硫酸铝中水电离出的C(H+)的比值比稀释前的比值增大 | |
| B. | a点溶液中有:c(H+)+c(Al3+)=c(OH-)+c(SO42-) | |
| C. | 体积和pH都相同的稀硫酸和硫酸铝溶液与等浓度的NaOH反应,消耗NaOH的体积相等 | |
| D. | b、c两溶液水电离出的c(OH-)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
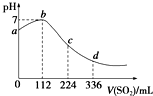
| A. | b点对应的溶液导电性最强 | |
| B. | 亚硫酸是比氢硫酸更弱的酸 | |
| C. | ab段反应是SO2+2H2S═3S↓+2H2O | |
| D. | 原H2S溶液的物质的量浓度为0.05mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com