
 ;该反应中,氧化产物是Cl2,还原产物是Cl2,氧化产物与还原产物的物质的量之比是5:1.
;该反应中,氧化产物是Cl2,还原产物是Cl2,氧化产物与还原产物的物质的量之比是5:1.分析 (1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;再结合元素守恒,配平各物质的系数;
(2)根据氧化还原反应中化合价变化及质量守恒定律判断反应物和生成物,并配平反应方程式、判断还原产物.
解答 解::(1)反应中KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目为 ,该反应中,氧化产物和还原产物都是Cl2,其中氧化产物与还原产物的物质的量之比是5:1,故答案为:
,该反应中,氧化产物和还原产物都是Cl2,其中氧化产物与还原产物的物质的量之比是5:1,故答案为: ;Cl2;Cl2;5:1;
;Cl2;Cl2;5:1;
(2)观察反应式可知镍从+2价变成+1价,化合价降了1,H2PO2-中的P为+1价变为H2PO3-中的P+3价,化合价升了2,据得失电子总数相等的原则,在镍前需配上系数2,H2PO2-前需配上系数1.再据原子个数守恒可知,左边反应物只有两个氧,而右边有三个,因此在反应物中肯定还有一个氧原子,而题目中说,该反应时在酸性条件下进行,所以反应物中应该是水参与了反应,所以可以得出2Ni2++H2PO2-+H2O=2Ni++H2PO3-+2H+,故答案为:2Ni2++H2PO2-+H2O=2Ni++H2PO3-+2H+.
点评 本题考查了氧化还原反应,明确反应中元素的化合价变化及原子守恒为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
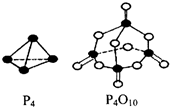 磷在氧气和氯气中都可以燃烧.
磷在氧气和氯气中都可以燃烧.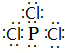 ;PCl3水解得到的亚磷酸(H3PO3)是一种二元弱酸,写出亚磷酸与足量NaOH反应的离子方程式H3PO3 +2OH-=HPO32-+2H2O;某温度下,0.1mol•L-1亚磷酸溶液c(H+)=2.5×10-2mol•L-1,除OH-之外其他离子浓度由大到小顺序是c(H+)>c(H2PO3-)>c(HPO32-).
;PCl3水解得到的亚磷酸(H3PO3)是一种二元弱酸,写出亚磷酸与足量NaOH反应的离子方程式H3PO3 +2OH-=HPO32-+2H2O;某温度下,0.1mol•L-1亚磷酸溶液c(H+)=2.5×10-2mol•L-1,除OH-之外其他离子浓度由大到小顺序是c(H+)>c(H2PO3-)>c(HPO32-).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤⑥ | C. | ②③⑤⑥⑦ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=1,b=2 | B. | a=2,b=1 | C. | a=2,b=2 | D. | a=3,b=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲原子最外层电子数比乙原子最外层电子数少 | |
| B. | 甲原子电子层数比乙原子电子层数多 | |
| C. | 1mol甲从酸中置换生成的氢气比1mol乙从酸中置换生成的氢气多 | |
| D. | 常温下,甲能与水反应生成氢气,而乙不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{7}{4}g$ | B. | 4.7 g | C. | 7.4 g | D. | $\frac{4}{7}g$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11gT2O含有的电子数为5NA | |
| B. | 常温下,0.2L 0.5mol•L-1NH4NO3溶液的氮原子数小于0.2NA | |
| C. | 含4molHCl的浓盐酸与足量二氧化锰反应转移的电子总数为NA | |
| D. | 标准状况下,2.24L H2S全部溶于水所得溶液中HS-和S2-离子激之和为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com