

分析 由元素的位置可知,①②③④⑤⑥分别为N、O、Na、Mg、Al、S,
(1)①为N元素;
(2)同主族元素从上到下原子半径逐渐增大;
(3)同周期元素从左到右金属性逐渐减弱;
(4)④的单质与⑥的最高价氧化物对应水化物的稀溶液的反应为镁和稀硫酸的反应.
解答 解:由元素的位置可知,①②③④⑤⑥分别为N、O、Na、Mg、Al、S,
(1)由元素在周期表中的位置可知①为N元素,故答案为:N;
(2)同主族元素从上到下原子半径逐渐增大,原子半径S>O,故答案为:<;
(3)同周期元素从左到右金属性逐渐减弱,则金属性Na>Mg,故答案为:>;
(4)④的单质与⑥的最高价氧化物对应水化物的稀溶液的反应为镁和稀硫酸的反应,反应的离子方程式为Mg+2H+=Mg2++H2↑,故答案为:Mg+2H+=Mg2++H2↑.
点评 本题考查元素周期表和元素周期律,为高频考点,把握元素的位置分析元素为解答的关键,注重基础知识的考查,题目难度不大.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:填空题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) 滴定前读数(mL)滴定后读数(mL) | |
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| B. | 向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| C. | 向NaHCO3溶液中加过量Ca(OH)2溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+═Ba2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
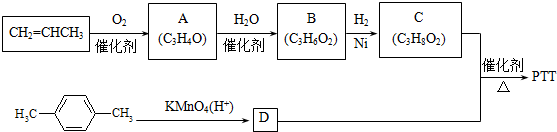
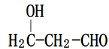 .
.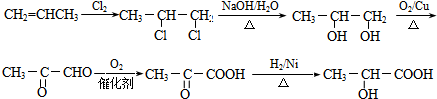 .
.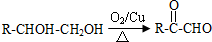
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
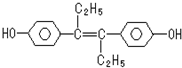
| A. | 该药物可以用有机溶剂萃取 | |
| B. | 可与NaOH反应但是不与Na2CO3发生反应 | |
| C. | 1mol该有机物不可以Br2发生取代反应 | |
| D. | 该有机物分子中,可能有16个碳原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡静置后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 溴苯(溴):加入CCl4溶液,充分振荡静置后,分液 | |
| D. | 苯中混有苯酚,加入氢氧化钠溶液,再用分液漏斗分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若R(OH)n为强碱,则W(OH)m也为强碱 | |
| B. | 若Y的最低负化合价为-2,则Z的最高正化合价为+6 | |
| C. | 若HnXOm为强酸,则Y是活泼非金属元素 | |
| D. | 若X的最高正化合价为+5,则五种元素一定都是非金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com