
| A. | 化合反应 | B. | 分解反应 | C. | 复分解反应 | D. | 置换反应 |
分析 含元素化合价变化的反应,一定为氧化还原反应,而置换反应中一定存在元素的化合价变化,以此来解答.
解答 解:A.化合反应不一定为氧化还原反应,如二氧化碳与水反应生成碳酸,故A不选;
B.分解反应不一定为氧化还原反应,如碳酸钙分解生成CaO和二氧化碳,故B不选;
C.复分解反应中一定不含元素的化合价变化,则一定不是氧化还原反应,故C不选;
D.置换反应中一定存在元素的化合价变化,如Zn与盐酸反应生成氯化锌和氢气,则一定为氧化还原反应,故D选;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意元素化合价的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
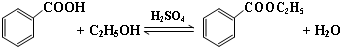
| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环己烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环己烷、乙醇和水共沸物 | 62.1 |


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
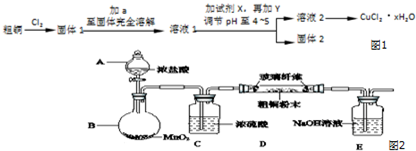
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将煤气化后再作为能源,可减少PM2.5引起的危害 | |
| B. | 农作物秸秆处理起来麻烦,利用价值低,适于就地露天焚烧 | |
| C. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| D. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油,可以实现厨余废物合理利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑧ | B. | ⑦⑧ | C. | ⑥⑦⑧ | D. | ②⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
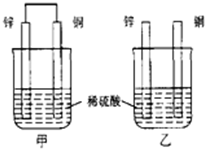
| A. | 两烧杯中铜片表面均无气泡产生 | |
| B. | 甲中铜片是正极,乙中铜片是负极 | |
| C. | 甲中电子从锌片流出,经导线流入铜片 | |
| D. | 产生气泡的速度甲比乙慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氯化铝溶液中滴加氨水 | B. | 在偏铝酸钠溶液中通入CO2 | ||
| C. | 在氯化铝溶液中滴加氢氧化钠溶液 | D. | 在硫酸铝溶液中滴加偏铝酸钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com