
硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、硬质玻璃管常作为气体和固体反应的场所,如图(其他装置省略,必要时可加热)。
下列实验描述不正确的是
| A.固体A为无水硫酸铜时,可以检验气体X中是否含有水蒸气 |
| B.固体A为铜时,可以除去N2中的O2 |
| C.在空气流作用下,加热氯化铁晶体得到纯净的无水氯化铁 |
| D.将氨气和空气混合气通过灼热的铂丝,可看到有红棕色气体生成 |
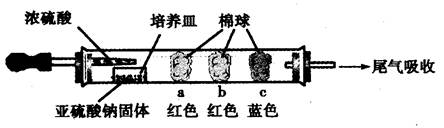
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | | 棉球变白,微热后又恢复红色 | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | | 棉球变为白色 | 结论:该气体具有 性 |
科目:高中化学 来源: 题型:填空题
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业,它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。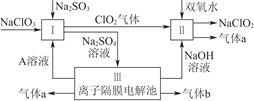
(1)双氧水的结构式为____________;Ⅰ中发生反应的还原剂是__________(填化学式)。
(2)Ⅱ中反应的离子方程式是_____________________________________________________________________________________________________________________________________。
(3)A的化学式是________,装置Ⅲ中A在________极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式:________________________________________________________________________________________________________________________________________________。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2。用离子方程式解释产生Cl2的原因:________________________________________________________________________
________________________________________________________________________。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量NaClO2,其中一份给以适当条件使之变质,另一份严格保存,均配成溶液,并分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量________(填“相同”“不相同”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或受热。实验室以电解法制备ClO2的流程如下: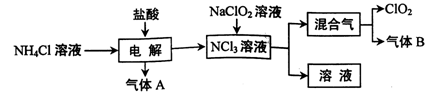
(1)ClO2中所有原子 (填“是”或“不是”)都满足8电子结构。上图所示方法制得的混合气中杂质气体B能使石蕊试液显蓝色,除去该杂质气体可选用 __;
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品。下列说法正确的是 ;
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,但该方法缺点是产率低、产品难以分离,还可能污染环境。写出该方法发生的化学方程式 ;
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是
,此法相比欧洲方法的优点是
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为 ,此法提高了生产及储存、运输的安全性,原因是____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Na2SO3是常用的抗氧剂。
(1)实验室通常用浓硫酸(1:1)和Na2SO3微热制备SO2气体,
反应方程式为: ,制备的SO2气体中通常含有水蒸气,下列干燥剂能干燥SO2气体的是: ;
A.浓硫酸 B.碱石灰 C.无水CaCl2
(2) 少量SO2气体通入NaOH溶液中可得NaOH和Na2SO3的混合溶液,向该混合溶液中加入少许溴水,振荡后溶液变为无色。碱性溶液中Br2与Na2SO3发生氧化还原反应,反应的离子方程式为______________;
(3)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告;
限选试剂:2 mol·L-1HCl;1 mol·L-1H2SO4;1mol·L-1HNO3;1 mol·L-1BaCl2;
1 mol·L-1Ba(NO3)2;0.1 mol·L-1AgNO3;CCl4;苯;新制饱和溴水;新制饱和氯水。
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液于试管A中,滴加2 mol·L-1HCl至溶液呈酸性,加入几滴________(填试剂),振荡 | ________,证明待测液中含SO32- |
| 步骤② | 另取少量待测液于试管B中,加入 ,再滴加适量 1 mol·L-1 BaCl2溶液 | |
| 步骤③ | 另取少量待测液于试管C中, ,振荡,静置后观察颜色 | 溶液分层,上层液体呈橙红色,证明待测液中很Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯气的用途十分广泛,除用于净水、环境消毒外,还用于生产盐酸、硅等。
(1)工业上可用氯气和石灰乳为原料制造漂白粉,漂白粉的有效成分是 。
(2)工业上生产半导体材料硅的流程如下:
①写出制备粗硅时反应的化学方程式: 。
②粗硅与氯气反应后得到沸点较低的液态四氯化硅中常混有一些高沸点、难挥发性液态杂质,必须进行分离提纯,其提纯方法为 (填字母)。
| A.蒸馏 | B.过滤 | C.萃取 | D.结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
固体硝酸盐加热易分解且产物较复杂。已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐的热分解反应方程式如下:
I.2KNO3 2KNO2+O2↑
2KNO2+O2↑
II.2Cu(NO3) 2 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
III.2AgNO3 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
(1)某固体可能由KNO3、Cu(NO3)2、AgNO3三种硝酸盐中的一种或几种组成。取适量该固体充分加热,得到一定量气体。若该气体经水充分吸收后,剩余气体的体积在同温同压下为吸收前的1/6。 (忽略氧在水中的溶解)
①若该固体只是由一种盐组成,则该盐为 。
②若该固体是混合物,则该混合物的可能组成为 。
(2)某学习小组以Mg(NO3)2为研究对象,通过实验探究其热分解的产物,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):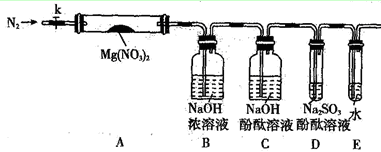
【实验步骤】
a.仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管A。
b.称取Mg(NO3)2固体3.7g置于A中,先通入一段时间N2,再关闭k,用酒精灯加热硬质玻璃管A。
c.待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1.0g。
①步骤a的目的是 ;
②依据已知的三个方程式,再根据剩余固体的质量写出Mg(NO3)2热分解方程式为: 。
③若A中固体为AgNO3,用以上实验装置进行实验时,D 中的现象为 ,用离子方程式表示出现该现象的原因:_____________________ 。
④从实验安全的角度判断该实验装置有无缺陷?若有,应如何改进? 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂之一。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 (反应①)。
(2)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,反应化学方程式为 (反应②)。
(3)次氯酸不稳定,容易分解,化学反应方程式为 (反应③)。
(4)反应①、反应②、反应③中,属于氧化还原反应的是(填反应编号) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A经如右图所示的过程转化为D, 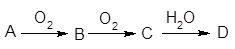
请回答下列问题:
(1)若A为非金属单质,且常温下为淡黄色固体,B为刺激性气味的无色气体,能使品红溶液褪色,D为强酸。
①D的化学式是 。
②在工业生产中B气体的大量排放被雨水吸收后形成了 而污染了环境。某工厂净化残余的B气体装置如图,则除去B气体的总反应方程式是 。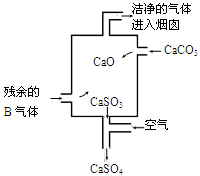
(2)若A是能使酚酞试液变红的气体。D是一种强酸。写出A→B的化学方程式 ;工业生产上,以34吨A为原料,最多可以生产63%的D酸 吨。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
普通玻璃中,Na2SiO3、CaSiO3、SiO2的物质的量之比是Na2SiO3∶CaSiO3∶SiO2=1∶1∶4。
(1)若以aNa2O·bCaO·mSiO2形式表示此玻璃的组成,则a∶b∶m=____________。
(2)若要制备1 000 kg上述玻璃,需要原料各多少千克?共可产生标准状况下的CO2气体多少升?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com