
| A. | -218 kJ/mol | B. | -109 kJ/mol | C. | +218 kJ/mol | D. | +109 kJ/mol |
分析 依据盖斯定律结合热化学方程式$\frac{①×3-②×3-③×2}{6}$计算得到CO气体还原足量FeO固体的热化学方程式,从而得出反应热.
解答 解:①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ/mol
②Fe2O3(s)+$\frac{1}{3}$CO(g)=$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H=-15.73 kJ/mol
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.4kJ/mol
依据盖斯定律计算$\frac{①×3-②×3-③×2}{6}$,得到:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol,
则1mol CO气体还原足量FeO固体得到Fe单质和CO2气体时对应的△H约为-218kJ/mol,
故选A.
点评 本题考查了热化学方程式书写方法,盖斯定律的计算应用,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 蛋白质可与茚三酮作用,显示特征颜色 | |
| B. | HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性 | |
| C. | 某些蛋白质跟浓硝酸作用会变黄 | |
| D. | 可以采用多次盐析或多次渗析的方法分离、提纯蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Y | Z | M | |
| W |
 .
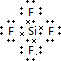
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果XY2是共价化合物,则X与Y的原子序数不可能相差1 | |
| B. | 如果X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液 | |
| C. | 如果X与Y的原子序数相差5,则离子化合物XY2不溶于水 | |
| D. | 如果XY2是离子化合物,则X与Y的原子序数可能相差9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯原子的结构示意图: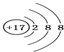 | |
| B. | 6个质子8个中子的碳元素的核素符号:12C | |
| C. | 氯化镁的电子式: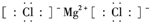 | |
| D. | 用电子式表示氯化氢的形成过程: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
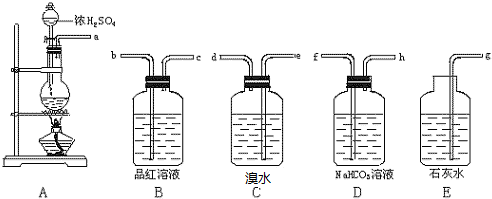
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com