
分析 (1)(2)(3)到平衡时,测得混合气体的压强为原来的$\frac{9}{10}$,则说明该反应为气体体积减小的反应,所以n=1,设转化了的A为3xmol,则
3A(g)+2B(g)?3C(g)+D(g)
起始(mol):3 2 0 0
转化(mol):3x 2x 3x x
平衡(mol):3-3x 2-2x 3x x
则有$\frac{3-3x+2-2x+3x+x}{5}$=$\frac{9}{10}$,据此求得x,进而可计算C表示的平均化学反应速率、转化率等物理量;
(4)将容器容积压缩为原来的一半,利用三段式可得平衡时各物质的物质的量,根据压强之比等于物质的量之比可求得转化的A的物质量,根据转化率=$\frac{已转化的量}{起始的量}$×100%进行计算;
解答 解:到平衡时,测得混合气体的压强为原来的$\frac{9}{10}$,则说明该反应为气体体积减小的反应,所以n=1,设转化了的A为3xmol,则
3A(g)+2B(g)?3C(g)+D(g)
起始(mol):3 2 0 0
转化(mol):3x 2x 3x x
平衡(mol):3-3x 2-2x 3x x
则有$\frac{3-3x+2-2x+3x+x}{5}$=$\frac{9}{10}$,据此求得x=0.5,
(1)根据上面的分析可知,n=1,故选A;
(2)前2s,以C表示的平均化学反应速率为$\frac{\frac{0.5×3}{2}}{2}$mol/(L•min)=0.375mol/(L•min),
故答案为:0.375mol/(L•min);
(3)达到平衡时,A的转化率为$\frac{3×0.5}{3}$×100%=50%,
故答案为:50%;
(4)将容器容积压缩为原来的一半,设转化了的A为3xmol,则
3A(g)+2B(g)?3C(g)+D(g)
起始(mol):3 2 0 0
转化(mol):3x 2x 3x x
平衡(mol):3-3x 2-2x 3x x
则有$\frac{3-3x+2-2x+3x+x}{5}$=$\frac{21}{25}$,据此求得x=0.8,所以A的转化率为$\frac{3×0.8}{3}$×100%=80%,
故答案为:80%.
点评 本题考查化学平衡的计算,题目难度不大,注意根据压强之比等于物质的量之比进行计算;


科目:高中化学 来源: 题型:解答题
| 乙醇 | 溴乙烷 | 1-丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl、NaOH、Ba(OH)2 | B. | HCl、KOH、NaCl | C. | H2SO4、HCl、NaCl | D. | H2SO4、NaOH、KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.| 压强/MPa SO2转化率 温度/℃ | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9989 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8528 | 0.8897 | 0.9276 | 0.9468 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
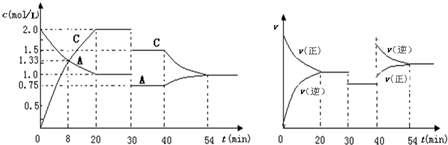
| A. | 0~20min用A物质表示反应的平均速率为0.005mol•L-1•min-1 | |
| B. | 该反应的正反应为吸热反应 | |
| C. | x=1,且30min时改变的反应条件是减压 | |
| D. | 在25min、35min、55min时化学平衡常数分别为K1、K2、K3,则K3>K2>K1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 上述反应为X+3Y?2Z,其平衡常数为1600 | |
| C. | 增大压强使平衡向生成Z的方向移动,平衡常数不变 | |
| D. | 若改变温度反应的平衡常数变大,则一定为升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质所含元素化合价升高的反应叫还原反应 | |
| B. | 在氧化还原反应中,失去电子的元素化合价降低 | |
| C. | 物质中某元素失去电子,则此物质是氧化剂 | |
| D. | 还原剂中必定有一种元素被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com