
【题目】(一)电解法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制。某校实验小组精制粗盐水的实验过程如下:
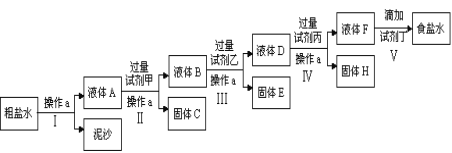
请回答以下问题:
(1)操作a的名称是______________,所用玻璃仪器有_________________;
(2)在第Ⅱ步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为(填化学式)_______________溶液;
(3)写出固体H所含物质的化学式_________________________________;
(4)在Ⅴ步中,逐滴加入试剂丁直至溶液无明显变化时,写出此过程中发生反应的离子方程式____________________________________________。
(二)某次实验需用0.4 mol·L-1 NaOH溶液500 mL。若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏低的是__________,对实验结果没有影响的是________(填字母代号)。
A.所用的NaOH中混有少量Na2O
B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥
C.配制溶液所用的容量瓶洗净后没有烘干
D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线
【答案】过滤 玻璃棒、普通漏斗、烧杯 NaOH CaCO3 BaCO3 H++OH-=H2O 2H++CO32-=CO2↑+H2O BEG C
【解析】
(一)流程是操作Ⅰ通过过滤除去不溶性杂质,得到溶液A中含有杂质离子Ca2+、Mg2+、Fe3+、SO42-杂质,加入过量试剂甲为氢氧化钠沉淀铁离子和镁离子,过滤得到溶液B中含有Ca2+、OH-、SO42-杂质,加入过量试剂乙为氯化钡沉淀硫酸根离子,过滤得到溶液D中含有OH-、Ca2+、Ba2+,加入过量碳酸钠溶液,除去Ca2+、Ba2+,过滤得到溶液F中含有氢氧根离子、碳酸根离子,加入适量盐酸到不再有气体产生得到较纯净的食盐水;
(二)分析操作对溶质的物质的量及溶液体积的影响,依据c=n/V进行误差分析,凡是使n偏小或者V偏大操作,都会导致溶液浓度偏低,反之导致溶液浓度偏高,据此分析解答。
(一)(1)在食盐水中,实现溶液和泥沙难溶物的分离可以采用过滤的方法,即操作a的名称是过滤,所用玻璃仪器有玻璃棒、普通漏斗、烧杯;
(2)粗盐中含有Ca2+、Mg2+、Fe3+、SO42-杂质,加入过量试剂氢氧化钠后,可以将镁离子以及铁离子形成氢氧化镁和氢氧化铁沉淀,即试剂甲为NaOH;
(3)氯化钡可以让硫酸根离子形成硫酸钡沉淀,碳酸钠可以让钙离子以及过量的钡离子形成碳酸钙和碳酸钡沉淀,并且碳酸钠必须加在氯化钡之后,因此固体H所含物质的化学式为CaCO3、BaCO3;
(4)在第Ⅴ步中,加入试剂盐酸可以把过量的氢氧化钠以及过量的碳酸钠除掉,此过程的离子反应方程式为H++OH-=H2O、2H++CO32-=CO2↑+H2O;
(二)A.所用的NaOH中混有少量Na2O,相同量的氧化钠生成氢氧化钠的物质的量多,所以导致溶质的物质的量偏大,溶液浓度偏高;
B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥,导致称取固体中含有氢氧化钠质量偏小,溶质的物质的量偏小,溶液浓度偏低;
C.配制溶液所用的容量瓶洗净后没有烘干,对溶质的物质的量和溶液体积都不产生影响,溶液浓度无影响;
D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作,冷却后溶液体积偏小,溶液浓度偏高;
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低;
F.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线,导致溶液体积偏小,溶液浓度偏高;
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线,导致溶液体积偏大,溶液浓度偏低;
所以使所配制的NaOH溶液的浓度偏低的是BEG;对实验结果没有影响的是C。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
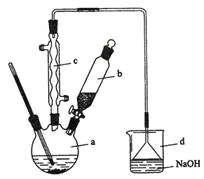
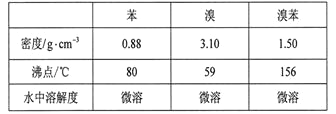
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是________________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用l0 mL水、8 mL l0%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必须是______(填入正确选项前的字母);
A重结晶 B过滤 C蒸馏 D萃取
(4)在该实验中,a的容积最适合的是______(填入正确选项前的字母)。
A、25 mL B、50 mL C、250 mL D、509 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但现在只有混有Na2SO4、NH4HCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。
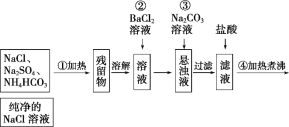
(已知:NH4HCO3![]() NH3↑+CO2↑+H2O)
NH3↑+CO2↑+H2O)
如果此方案正确,回答下列问题:
(1)操作①可选择的主要仪器是____________、____________。
(2)操作②不用硝酸钡溶液,其理由是__________________________________________。
(3)进行操作②后,如何判断SO42 已除尽,方法是_________________________。
(4)操作③的目的是________________。
(5)操作④的目的是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据以下几个反应:
①Cl2+2KI===2KCl+I2 ②2FeCl2+Cl2===2FeCl3
③2FeCl3+2KI===2FeCl2+2KCl+I2
④I2+SO2+2H2O===H2SO4+2HI
判断氧化性由强到弱的顺序是
A. Cl2>I2>Fe3+>SO2 B. Cl2>Fe3+>I2>SO2
C. Cl2>Fe3+>SO2>I2 D. Fe3+>I2>Cl2>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B = C +D,6g A和12g B恰好完全反应,生成C和9 g D,则A:C
A. 3:2 B. 1:4
C. 1:1 D. 2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)M2O7x- 与S2-在酸性溶液中发生如下反应:M2O7x- +3S2-+14H+=2M3++3S+7H2O,则x等于________ ,氧化产物与还原产物的物质的量比为_______。
(2)NaHSO4与Ba(OH)2在溶液中按物质的量之比为1:1混合反应的离子方程式_____;
(3)用单线桥标出该反应中电子转移的方向和数目________
Fe3O4 +4CO![]() 3Fe+4CO2
3Fe+4CO2
(4)过量CO2通入NaOH溶液中的离子方程式__________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期,A基态原子的2p轨道上有2个未成对电子,C的最外层电子数是次外层电子数的3倍,C与D同主族相邻,E位于周期表的ds区,最外层只有一对成对电子。请回答下列问题:
(1)写出各元素符号:A________,B________,C________,D________,E________。
(2)D元素在元素周期表中的位置是_______________,基态E原子的电子占有_____种能量不同的原子轨道。
(3)A元素可形成多种单质,其中分子晶体的分子式为________;原子晶体的名称是_______,其每个晶胞(如图甲)实际含有______个A原子;A有一种单质为层状结构的晶体,晶体中存在的作用力有____________,晶体中每个最小环含有_____个原子。
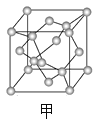
(4)①写出B的单质的电子式___________,化合物AC2的结构式___________。
②用KMnO4酸性溶液吸收DC2气体时,MnO4﹣被还原为Mn2+,该反应的离子方程式为________________________________________________。
(5)D与E能形成化合物X,X的一种晶体晶胞结构如图乙所示,X的化学式为______,D离子的配位数为______;若晶胞边长为a cm,则晶体X的密度计算式为ρ=______________gcm-3(用a和NA的代数式表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com