
| A. | 次氯酸钙的化学式:CaClO | |
| B. | 氟离子结构示意图: | |
| C. | 质量数为137的钡原子:${\;}_{137}^{56}$Ba | |
| D. | 硫酸的电离方程式:H2SO4=2H++SO42- |
分析 A.次氯酸钙中阳离子与阴离子个数比为1:2;
B.氟离子的核电荷数为9,核外电子总数为10;
C.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
D.硫酸为强电解质,在溶液中完全电离出氢离子和硫酸根离子.
解答 解:A.漂白粉有效成分为次氯酸钙,其化学式为Ca(ClO)2,故A错误;
B.氟离子的核电荷数为9,氟离子正确的结构示意图为: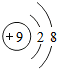 ,故B错误;
,故B错误;
C.钡元素的质子数为56,质量数为137的钡原子可以表示为:56137Ba,故C错误;
D.硫酸为强电解质,硫酸的电离方程式为:H2SO4=2H++SO42-,故D正确;
故选D.
点评 本题考查化学用语的表示方法,为高频考点,题目难度中等,试题基础性强,涉及化学式、离子结构示意图、电离方程式及原子表示方法等,注意掌握常见化学用语的概念及书写原则,试题侧重考查学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | 6个碳原子有可能都在一条直线上 | |
| B. | 分子中最多有12个原子在同一平面上 | |
| C. | 6个碳原子有可能都在同一平面上 | |
| D. | 6个碳原子不可能都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

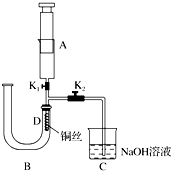
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 电解质溶液 | HCl | AgNO3 | BaCl2 | KOH |
| pH值变化 | 减小 | 增大 | 变大 | 不变 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 判据△H-T△S适合任何条件下的反应 | |
| B. | 放热反应在室温下不一定自发进行 | |
| C. | 自发反应一定是熵增大,非自发反应一定是熵减少或不变 | |
| D. | 如果△H和△S均为正值,当温度升高时,反应可能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+,Na+,NO3-,Cl- | B. | K+,Na+,NO3-,Cl- | ||
| C. | K+,Na+,Cl-,AlO2- | D. | K+,NH4+,SO42-,NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应 Fe+2H+═Fe3++H2↑ | |
| B. | 氢氧化铝与足量盐酸反应 Al(OH)3+3H+═Al3++3H2O | |
| C. | 钠和冷水反应 Na+2H2O═Na++H2↑+OH- | |
| D. | 铜片与稀硝酸反应 Cu+NO3-+4H+═Cu2++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3的百分含量不变 | B. | N2的体积分数增大 | ||
| C. | N2的转化率增大 | D. | NH3的百分含量增小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com