
| A、溴水中有下列平衡:Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 |
| B、对2HI(g)?H2(g)+I2(g),平衡体系增大压强可使颜色变深 |
| C、反应CO+NO2?CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动 |
| D、合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施(N2(g)+3H2(g)?2NH3(g);△H<0) |


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
| A、1mol任何气体的体积都是22.4L |
| B、1molH2的质量是2g?mol-1,它所占的体积是22.4L?mol-1 |
| C、标准状况下,1moL任何物质所占的体积都约为22.4L |
| D、标准状况下,1mol任何气体所占的体积都约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度 |
| B、加入NH4Cl固体 |
| C、通入HCl气体 |
| D、加入1mol/LNaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
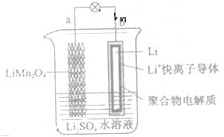 水锂电是当今锂电池研发的前沿和方向之一,理论上水锂电能量密度大,能量效率高达95%.关于如图所示的水溶液锂离子电池体系的叙述正确的是( )
水锂电是当今锂电池研发的前沿和方向之一,理论上水锂电能量密度大,能量效率高达95%.关于如图所示的水溶液锂离子电池体系的叙述正确的是( )| A、a为电池的负极 |
| B、放电时,a极锂的化合价发生变化 |
| C、放电时,溶液中Li+从b向a迁移 |
| D、电池充电反应为Li1-xMn2O4+xLi═LiMn2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
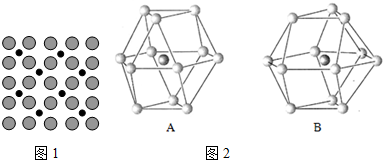
| N |
| Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温常压下,2.8 g N2和CO的混合气体所含电子数为1.4NA | ||
| B、1 molCl2与足量Fe完全反应,转移3NA个电子 | ||
C、1 L 0.1 mol?L-1 NaHCO3溶液中含有0.1 NA个HCO
| ||
| D、7.8g Na2O2中阴离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | |
| 盐酸体积/mL | 100 | 100 | 100 |
| 试样Y/g | 2.22 | 4.44 | 6.66 |
| 标准状况下气体体积 | 1.344 | 2.24 | 2.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
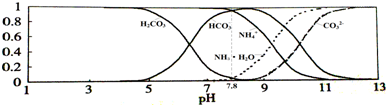
| A、NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3?H2O)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| B、往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小 |
| C、通过分析可知常温下Kb(NH3?H2O)>Ka1(H2CO3) |
| D、当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3?H2O)>c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com