
| A. | 生成1 mol NaNO3需消耗0.4 mol KMnO4 | |
| B. | 反应过程中溶液的pH减小 | |
| C. | 该反应中NO${\;}_{2}^{-}$被还原 | |
| D. | X可以是盐酸 |
分析 该反应中锰元素化合价由+7价变为+2价,N元素化合价由+3价变为+5价,结合元素守恒、硝酸钠和高锰酸钾之间的关系式分析解答.
解答 解:该反应中Mn元素化合价由+7价变为+2价,所以MnO4-是氧化剂,NO2-应该作还原剂,亚硝酸根离子中N元素应该失电子化合价升高,酸性条件下,应该生成硝酸根离子,根据转移电子相等、原子守恒配平方程式为2MnO4-+5NO2-+6H+=2Mn2++5 NO3-+3H2O,
A.根据转移电子守恒得,生成1molNaNO3需消耗KMnO4的物质的量=$\frac{1mol×(5-3)}{(7-2)}$=0.4mol,故A正确;
B.根据元素守恒、电荷守恒知,X是H+,氢离子参加反应导致溶液中氢离子浓度降低,则溶液的pH增大,故B错误;
C.该反应中N元素化合价由+3价变为+5价,所以亚硝酸根离子失电子被氧化,故B错误;
D.根据BX是酸,但不可是还原性的盐酸,故D错误.
故选A.
点评 本题考查了氧化还原反应,为高频考点,注意根据反应中元素的化合价变化为解答的关键,注意转移电子守恒分析,X中的粒子需要电荷守恒,题目难度中等.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:填空题
 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 化合物 | HCl | NaOH | Cu2(OH)2SO4 | FeSO4•7H2O |
| 氧化物 | H2O | Na2O | CO | Fe3O4 |
| 电解质 | 食盐水 | SO2 | H2SO4 | 铁 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3N4 晶体是分子晶体 | |
| B. | C3N4 晶体中微粒间通过离子键结合 | |
| C. | C3N4 晶体中C-N键的键长比金刚石中C-C键的键长要长 | |
| D. | C3N4 晶体中每个C原子连接4个N 原子,而每个N原子连接3个C原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
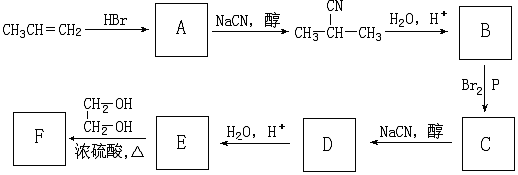
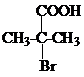 +NaCN$\stackrel{醇}{→}$NaBr+
+NaCN$\stackrel{醇}{→}$NaBr+ ,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$
,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$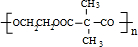 +2nH2O.
+2nH2O.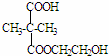 ,②分子内含有一个七元环
,②分子内含有一个七元环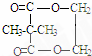 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论或目的 | |
| A | 向纯碱中滴加足量浓盐酸,将所得气体通入硅酸钠溶液中,溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
| B | 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 该溶液中一定含有大量的SO42- |
| C | 取少量Fe(NO3)2试样加水溶液后加稀硫酸酸化,滴加KSCN溶液,溶液变为红色 | 该Fe(NO3)2试样已经变质 |
| D | 处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解 | 目的:将不溶于酸的沉淀转化为易溶于酸的沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com