
工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需热量为( )
A.247.3 kJ B.494.6 kJ
C.2.76×103 kJ D.5.52×103 kJ
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
煤燃烧的反应热可通过以下两个途径来利用:
a.利用煤在充足的空气中直接燃烧产生的反应热;
b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为
a.C(s)+O2(g)====CO2(g) ΔH=E1 ①
b.C(s)+H2O(g)====CO(g)+H2(g) ΔH=E2 ②
H2(g)+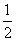 O2(g)====H2O(g) ΔH=E3 ③
O2(g)====H2O(g) ΔH=E3 ③
CO(g)+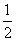 O2(g)====CO2(g) ΔH=E4 ④
O2(g)====CO2(g) ΔH=E4 ④
回答下列问题:
(1)与途径a相比途径b有较多的优点,即____________________________。
(2)上述四个热化学方程式中的反应__________________中ΔH>0。
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是____________。
A.a比b多 B.a比b少 C.a与b在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知一种[H+]=1×10-3 mol·L-1的某酸与一种[OH-]=1×10-3 mol·L-1的某碱等体积混合后溶液呈酸性,其原因可能是( )
A.稀的强碱与浓的强酸反应
B.等物质的量浓度的一元强酸和一元弱碱反应
C.浓的弱酸与稀的强碱溶液反应
D.生成一种强酸弱碱盐
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W为短周期元素,原子半径X:99 pm Y:154 pm Z:125 pm W:117 pm,X 、Y、 W位置如图所示(副族省略),X、Y、Z的最高价氧化物对应的水化物相互能反应,下列说法正确的是(双选)( )
| X | ||||
| Y | W |
A.元素Z处于周期表的阴影位置
B.非金属性:X>W
C.X与W形成化合物熔点很高,为离子化合物
D.Y、W的最高价氧化物对应的水化物能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
碘与氢气反应的热化学方程式如下:
①I2(g)+H2(g)2HI(g) ΔH=-9.48 kJ·mol-1
②I2(s)+H2(g)2HI(g) ΔH=+26.48 kJ·mol-1
下列判断正确的是( )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应①的产物比反应②的产物稳定
D.反应②的反应物总能量比反应①的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
为了探究温度、硫酸铜对锌与稀硫酸反应速率的影响规律,某同学设计如下方案:
| 编号 | 纯锌粉质量 | 0.2 mol·L-1硫酸体积 | 温度 | 硫酸铜固体质量 |
| Ⅰ | 2.0 g | 10.0 mL | 25℃ | 0 |
| Ⅱ | 2.0 g | 10.0 mL | t℃ | 0 |
| Ⅲ | 2.0 g | 10.0 mL | 35℃ | 0.2 g |
| Ⅳ | 2.0 g | 10.0 mL | 35℃ | 4.0 g |
下列推断合理的是( )
A.为了选择Ⅱ和Ⅲ实验探究硫酸铜对反应速率的影响,必须控制t=25
B.待测物理量是收集等体积(相同条件)气体所需要的时间,时间越长,反应越快
C.根据该方案,还可以探究硫酸浓度对反应速率的影响
D.根据该实验方案得出反应速率大小可能是Ⅲ>Ⅱ>Ⅰ>Ⅳ
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学实验小组的同学用下列仪器组装两套完全相同的装置,定量探究浓度对反应速率的影响。
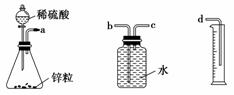
(1)为达到本实验的目的,其装置连接顺序为a连________,________连________。
(2)连接好装置后的下一步操作是__________________________________________________________。
(3)锥形瓶中发生反应的离子方程式为__________________________________________________________。
(4)两套装置的分液漏斗所装的试剂分别为1 mol·L-1硫酸和4 mol·L-1硫酸,该小组同学要测定并记录的数据如下表:
| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1 mol·L-1硫酸 | 10 mL | t1 | v1 |
| 4 mol·L-1硫酸 | 10 mL | t2 | v2 |
该小组同学通过实验得到的结果是:v1小于v2,其定量依据是________。
(5)另有一组同学测定了每隔一分钟,锥形瓶中硫酸的浓度,记录结果如下:
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 硫酸浓度(mol·L-1) | 4.0 | 3.8 | 3.5 | 3.1 | 2.6 | 2.2 | 1.9 | 1.8 | … |
请在给定的坐标图中作出v(H2)-t的图像。
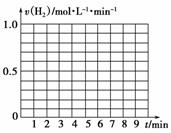
请解释0到4 min时该化学反应速率随时间变化的原因:__________________________________________________________
__________________________________________________________。
(6)除上述实验方案可定量测定该反应的化学反应速率外,还可能有的实验测定方法有:__________________________________________________________
__________________________________________________________。(任写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某酸性溶液中含有Ba2+、Fe3+,则下列能与上述离子共存的离子组是( )
|
| A. | CO32﹣、SO42﹣、NH4+、Na+ | B. | Cl﹣、SCN﹣、NO3﹣、Cu2+ |
|
| C. | Br﹣、I﹣、Mg2+、Na+ | D. | H+、Cl﹣、NO3﹣、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
某烃的结构简式为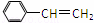 ,它可能具有的性质是( )
,它可能具有的性质是( )
|
| A. | 能使溴水褪色,但不能使酸性KMnO4溶液褪色 |
|
| B. | 与足量氢气反应生成苯乙烷 |
|
| C. | 能发生加聚反应,生成物可用表示 |
|
| D. | 易溶于水,也易溶于有机溶剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com