
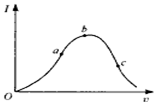
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:分析 (1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强;
(2)导电能力越强,离子浓度越大,氢离子浓度越大;
(3)加水稀释,促进弱电解质的电离,越促进醋酸电离;溶液中氢离子浓度越小,对水的电离抑制程度越小;
(4)要使醋酸根离子浓度增大,可以采用加热、加入含有醋酸根离子的物质、加入和氢离子反应的物质等方法.
解答 解:(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强,冰醋酸以分子形式存在,不电离,无自由移动的离子,所以不导电,
故答案为:冰醋酸以分子形式存在,不电离,无自由移动的离子,所以不导电;
(2)导电能力越强,离子浓度越大,氢离子浓度越大,因此氢离子浓度由小到大的顺序为c<a<b,
故答案为:c<a<b;
(3)因为加水稀释,促进弱电解质的电离,所以溶液越稀,醋酸电离程度越大,CH3COOH的电离程度最大的是c;
溶液中氢离子浓度越小,对水的电离抑制程度越小,c点氢离子浓度最小,水的电离程度最大,
故答案为:c;c;
(4)醋酸的电离平衡CH3COOH?CH3COO-+H+,
A.加热,电离平衡正向移动,c(CH3COO-)提高,故A正确;
B.加盐酸,增大了c(H+),电离平衡逆向移动,c(CH3COO-)降低,故B错误;
C.加冰醋酸,电离平衡正向移动,c(CH3COO-)提高,故C正确;
D.加入固体KOH,降低了c(H+),电离平衡正向移动,c(CH3COO-)提高,故D正确;
E.加水,c(CH3COO-)降低,故E错误;
F.加固体CH3COONa,c(CH3COO-)提高,故F正确;
G.加Zn粒,降低了c(H+),电离平衡正向移动,c(CH3COO-)提高,故G正确;
故答案为:ACDFG.
点评 本题考查弱电解质的电离,题目难度中等,掌握弱电解质电离平衡及影响因素是解题的关键,注意加水稀释醋酸,能促进醋酸电离,但溶液中醋酸根离子增大的量远远小于水体积增大的量,所以醋酸根离子浓度减小,为易错点.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCN分子的结构式:H-C≡N | B. | Se的简化电子排布式:[Ar]4s24p4 | ||
| C. | F-离子的结构示意图: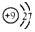 | D. | 二氧化碳的电子式 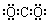 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③④ | C. | ①③⑤ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b>a>c | B. | c>a>b | C. | c>b>a | D. | a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
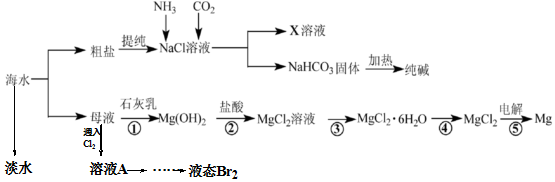
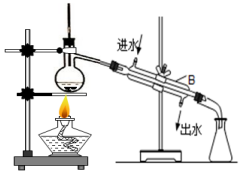
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

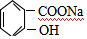 .
.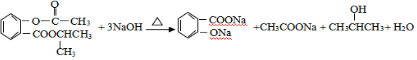 .
.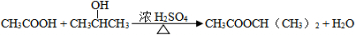 .
.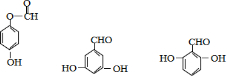 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

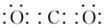 ,若在C池中生成64gCu,则整个装置中共生成H2SO42mol.
,若在C池中生成64gCu,则整个装置中共生成H2SO42mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com