
| 检验方法 | 沉淀法 | 显色法 | 气体法 |
| 判断依据 | 反应中有沉淀生成或溶解 | 反应中有颜色变化 | 反应中有气体生成 |
| A、CO32----------------气体法 |
| B、SO42------------------沉淀法 |
| C、H+--------------------显色法 |
| D、Cl---------------------气体法 |


科目:高中化学 来源: 题型:
| 待提纯的物质 | 选用的试剂 | 相应离子方程式 |
| (1)Mg (Al) | ||
| (2)FeCl3(FeCl2) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 已知下列反应(反应所需的条件、反应物的浓度和方程式中各物质的化学计量数均已略去):
已知下列反应(反应所需的条件、反应物的浓度和方程式中各物质的化学计量数均已略去):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
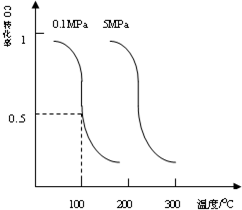 研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢的课题.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图.CO转化率随温度变化的规律是
为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图.CO转化率随温度变化的规律是查看答案和解析>>
科目:高中化学 来源: 题型:
| c(A) |
| c(B) |
| c(A) |
| c(B) |
| A、在该温度下,保持容积固定不变,向容器内补充了B气体,则a>b |
| B、保持温度、压强不变,充入惰性气体,则有a<b |
| C、若其他条件不变,升高温度,则有a<b |
| D、若a=b,容器中一定使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2FeCl2+Cl2=2FeCl3化合反应 | ||||
B、3CO+Fe2O3
| ||||
C、2KClO3
| ||||
| D、H2CO3=CO2↑+H2O分解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com