
| A. | 相同温度下,颗粒大小相同的锌粒分别与pH值相同的硫酸和盐酸反应 | |
| B. | A+B$\stackrel{500℃}{→}$C;D+E$\stackrel{100℃}{→}$F | |
| C. | 相同温度下,与同浓度盐酸反应的锌粒和铁粉 | |
| D. | G+H→W+Q(Q>0),其他条件相同时分别在200℃和100℃时反应 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 盐酸 | B. | NaOH溶液 | C. | 氨水 | D. | KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 NaHCO3溶液:K+、Fe3+、Cl-、NO3- | |
| B. | 使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Na+ | |
| C. | 常温下由水电离出的c(H+)=1×10-13mol•L-1的溶液中:Mg2+、Na+、SO32-、NO3- | |
| D. | 常温下在c(H+)=1×10-13mol•L-1的溶液中:Na+、K+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2不溶于水,因此不属于酸性氧化物 | |
| B. | CO2通入水玻璃中可得硅酸,说明碳酸酸性大于硅酸 | |
| C. | SiO2是酸性氧化物,它不溶于任何酸 | |
| D. | SiO2晶体由SiO2分子构成,1个Si原子连接2个O原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质溶液的浓度越大,其导电性一定越强 | |
| B. | 熔融态能导电的物质一定是离子化合物 | |
| C. | 强极性键的共价化合物不一定都是强电解质 | |
| D. | 多元酸、多元碱的导电性一定比一元酸、一元碱的导电性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
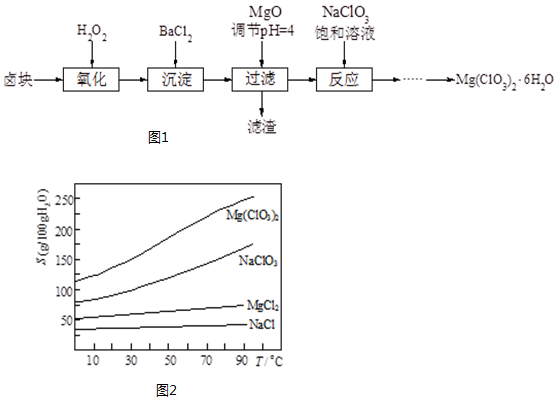
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com