
| A. | 用澄清石灰水鉴别CO2和SO2 | |
| B. | 用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 用CO2鉴别NaAlO2溶液和NaClO溶液 | |
| D. | 用Ba(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液 |
分析 A.二者均使石灰水变浑浊;
B.Br2(g)和NO2均能使碘化钾淀粉试纸变蓝;
C.CO2与NaAlO2溶液反应生成白色沉淀;
D.Ba(OH)2溶液与Na2CO3溶液和NaHCO3溶液反应均生成白色沉淀.
解答 解:A.二者均使石灰水变浑浊,现象相同不能鉴别,故A不选;
B.Br2(g)和NO2均能使碘化钾淀粉试纸变蓝,现象相同不能鉴别,故B不选;
C.CO2与NaAlO2溶液反应生成白色沉淀,而NaClO反应不生成沉淀,现象不同,可鉴别,故C选;
D.Ba(OH)2溶液与Na2CO3溶液和NaHCO3溶液反应均生成白色沉淀,现象相同不能鉴别,故D不选;
故选C.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、性质差异及发生的反应和现象为解答的关键,侧重分析与实验能力的考查,注重元素化合物知识与实验的结合,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
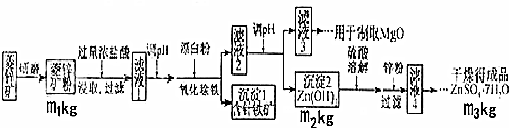
| 沉淀化学式 | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
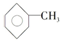 ,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )
,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AgI悬浊液中滴加少量NaCl溶液,沉淀转化为白色 | |
| B. | 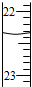 滴定达终点时,如图滴定管的正确读数为23.65 mL | |
| C. | 25℃时,在Mg(OH)2悬浊液中加入少量NH4Cl固体后,c(Mg2+)增大 | |
| D. | 测定溶液的pH时,应先将pH试纸润湿,然后进行检测 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有④ | B. | 只有⑤ | C. | ①②③ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com