
【题目】向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( ) 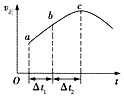
A.反应物的总能量低于生成物的总能量
B.△t1=△t2时,CO的转化率:a~b段小于bc段
C.反应在c点达到平衡状态
D.反应物浓度:a点小于b点
【答案】B
【解析】解:A.从a到c正反应速率增大,之后正反应速率减小,说明反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,说明该反应为放热反应,即反应物的总能量高于生成物的总能量,故A错误; B.着反应的进行,正反应速率越快,消耗的CO就越多,CO的转化率将逐渐增大,所以△t1=△t2时,CO的转化率:a~b段小于bc段,故B正确;
C.a化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,c点对应的正反应速率显然还在改变,故一定未达平衡,故C错误;
D.随到b时正反应速率增加,反应物浓度随时间不断减小,所以反应物浓度:a点大于b点,故D错误;
故选B.
由题意可知一个反应前后体积不变的可逆反应,由于容器恒容,因此压强不影响反应速率,所以在本题中只考虑温度和浓度的影响.结合图象可知反应速率先增大再减小,因为只要开始反应,反应物浓度就要降低,反应速率应该降低,但此时正反应却是升高的,这说明此时温度的影响是主要的,由于容器是绝热的,因此只能是放热反应,从而导致容器内温度升高反应速率加快.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 27g铝箔在酒精灯上充分加热反应转移电子总数是3NA
B. 84g还原铁粉与水蒸气完全反应转移电子总数是4NA
C. 常温常压下,11.2 L CO2 与足量Na2O2反应转移的电子数为0.5NA
D. 7.8gNa2O2中含有的阴、阳离子的总数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=﹣Q1 kJmol﹣1 2H2(g)+O2(g)═2H2O(g);△=﹣Q2 kJmol﹣1 ,
2H2(g)+O2(g)═2H2O(l);△H2=﹣Q3 kJmol﹣1
常温下,取体积比2:3的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为( )
A.0.4Q1+0.15Q2
B.0.2Q1+0.05Q2
C.0.2Q1+0.15Q3
D.0.2Q1+0.3Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)═4NO(g)+6H2O(g) 在2L的密闭容器中进行,1分钟后,NH3减少了0.12mol,则平均每秒钟各物质浓度变化正确的是( )
A.NH3:0.002 molL﹣1
B.H2O:0.002 molL﹣1
C.NO:0.001 molL﹣1
D.O2:0.001 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化,通常主要表现为热量的变化.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.测定中和热的实验装置如图所示: 
(1)该图中有两处仪器未画出,它们是、 .
(2)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式为(中和热数值为57.3kJ/mol) .
(3)取55mLNaOH溶液和25mL硫酸溶液进行实验,实验数据如表.
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 30.1 |
2 | 27.0 | 27.4 | 27.2 | 33.3 |
3 | 25.9 | 25.9 | 25.9 | 29.8 |
4 | 26.4 | 26.2 | 26.3 | 30.4 |
近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm2 , 中和后生成溶液的比热容c=4.08J/(g℃).则中和热△H=(取小数点后一位).
(4)有关中和热测定实验,下列说法错误的是 a.用温度计测定NaOH溶液起始温度后马上直接测定H2SO4溶液的温度会导致中和热数值比57.3低
b.温度计的冲洗液应倒入小烧杯参与反应
c.混合硫酸和氢氧化钠溶液时应分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.若装置完全相同,操作均没失误,取110mLNaOH溶液和50mL硫酸溶液进行实验,误差比55mLNaOH溶液和25mL硫酸溶液进行实验误差小.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列反应:
①、2H2O+Cl2+SO2=H2SO4+2HCl
②、 KMnO4+ HCl(浓)= KCl+__MnCl2+___Cl2↑+___H2O
针对上述两个反应回答:
(1)配平②的化学方程式________;
(2)用单线桥标出①中电子转移的方向和数目________;
(3)Cl2、SO2和KMnO4的氧化性强弱顺序为____;
(4)反应①中氧化产物和还原产物的物质的量之比为___;
(5)反应②中氯化氢表现出的性质是___。
A.还原性 B.酸性 C.氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在容积不变的密闭容器内进行反应:2NO+2CON2+2CO2 △H<0.曲线a表示NO的转化率与反应时间的关系,若改变初始条件,使反应过程按照曲线b进行,可采取的措施是( ) 
A.加催化剂
B.降低温度
C.增大NO的浓度
D.缩小容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.在稀溶液中,H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ
C.由C(s,石墨)=C(s,金刚石)△H=+1.90kJ/mol可知,石墨没有金刚石稳定
D.在101kPa时,2g的氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=﹣285.8kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com