
【题目】某化学兴趣小组欲测定KClO3溶液与NaHSO3溶液反应的化学反应速率。所用试剂为![]() 溶液和
溶液和![]() 溶液,所得数据如图所示。已知:
溶液,所得数据如图所示。已知:![]() 。
。
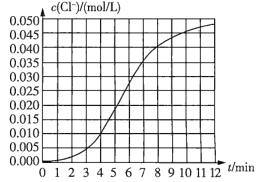
(1)根据实验数据可知,该反应在0~4min内的平均反应速率![]() _______
_______![]() 。
。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大后减小。某小组同学针对这一现象进一步探究影响该化学反应速率的因素,具体方法如表所示。
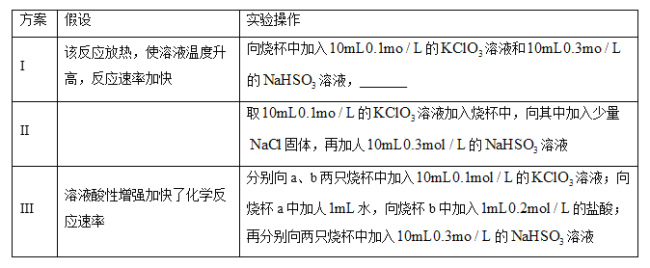
①补全方案I中的实验操作:_______。
②方案II中的假设为_______。
③除I、II、III中的假设外,还可以提出的假设是_______。
④某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:_______。
⑤反应后期,化学反应速率变慢的原因是_______。
【答案】0.0025 插入温度计 生成的Cl-加快了化学反应速率 生成的SO42-加快了化学反应速率 将1mL水改为![]() 的NaCl溶液 反应物浓度减小
的NaCl溶液 反应物浓度减小
【解析】
(1)根据实验数据可知,该反应在 0~4min 内生成氯离子的浓度是0.010mol/L,所以平均反应速率![]() ;
;
(2)①由于是假设该反应放热,反应过程放出热量使溶液温度升高,反应速率加快,因此需要测量反应过程中溶液温度的变化,所以需要插入温度计;
②方案I、II相比较,II中加入了少量氯化钠,所以方案II中的假设为生成的Cl-加快了化学反应速率;
③由于反应中还有硫酸根离子生成,则除I、II、III中的假设外,还可以提出的假设是生成的SO42-加快了化学反应速率;
④为防止氯离子对实验的干扰,则改进措施是将1mL水改为1mL0.2mol/L的NaCl溶液;
⑤反应后期反应物浓度减小,因此化学反应速率变慢。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B.NF3和BF3的杂化方式不同,前者是sp2后者是sp3
C.HCHO、CH3—、SO3的分子空间构型相同
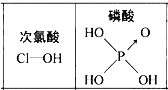
D.由图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率有效的是( )
A.![]() 与稀硫酸反应制取H2时,改用浓硫酸
与稀硫酸反应制取H2时,改用浓硫酸
B.Na与水反应时,增大水的用量
C.在K2SO4溶液与BaCl2溶液反应时,增大压强
D.在密闭容器中进行反应 时,压缩容器体积,增大压强
时,压缩容器体积,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙炔酸甲酯(CH≡C-COOCH3 )是一种重要的有机化工原料,沸点为103℃。实验室制备少量丙炔酸甲酯的反应为:CH≡C-COOH+CH3OH![]() CH≡C-COOCH3+H2O。实验步骤如下:
CH≡C-COOCH3+H2O。实验步骤如下:
步骤1:在反应瓶中加入14 g丙炔酸、50 mL甲醇和2 mL浓硫酸,搅拌加热回流一段时间;
步骤2:蒸出过量的甲醇(装置见图);
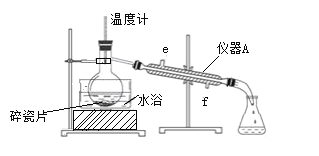
步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤,分离出有机相;
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得7.56g丙炔酸甲酯。
(1)步骤1中,加入过量甲醇的目的是________。
(2)步骤2中,图中所示的装置中仪器A的名称是________,自来水从________(填“e”或“f”)进入该仪器;加入碎瓷片的目的是________。
(3)步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是________;分离出有机相的操作名称为________。
(4)步骤4中,蒸馏时不能用水浴加热的原因是________。
(5)丙炔酸甲酯的产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,直到近年来人们才研究出来其成分为BaCuSi4O10,BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均具有Cun+离子,n=___,基态时该阳离子的价电子排布式为______。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是___元素。
(3)合成“中国蓝”、“中国紫”的原料有BaCO3,孔雀石Cu2(OH)2CO3和砂子(SiO2)。SiO2晶体中Si原子的杂化轨道是由______轨道(填轨道的名称和数目)和________轨道杂化而成的。
(4)现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源一种阴离子是正四面体的天然钡矿中,则最可能的钡矿化学式是______。
(5)在5500年前,古代埃及人就己经知道如何合成蓝色颜料—“埃及蓝”CaCuSi4O10,其合成原料中用CaCO3代替了BaCO3,其它和“中国蓝”一致。CO32一中键角∠OCO为___。根据所学,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更___(填“高”或“低”)。
(6)自然界中的SiO2,硬度较大,主要原因是___。下图为SiO2晶胞中Si原子沿z轴方向在xy平面的投影图(即俯视投影图),其中O原子略去,Si原子旁标注的数字表示每个Si原子位于z轴的高度,则SiA与SiB的距离是_____。
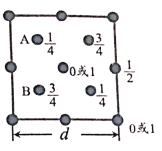
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
(1)当反应达到平衡时,N2和H2的浓度比是________;N2和H2的转化率比是________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量__________,密度__________。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气中含有高浓度的![]() 、
、![]() ,在排放前必须进行脱硫、脱硝处理。回答下列问题:
,在排放前必须进行脱硫、脱硝处理。回答下列问题:
(1)利用![]() 可以将氮的氧化物还原为
可以将氮的氧化物还原为![]() 。
。
已知:![]()
![]()
![]()
![]()
则反应![]() 的
的![]() ________
________![]() 。
。
(2)在体积为1L的恒容密闭容器里,充入![]() 和
和![]() ,发生反应为:
,发生反应为:![]()
![]() ,得
,得![]() 随温度变化如图所示:
随温度变化如图所示:

①a点时,反应是否已达平衡状态________(填“是”或“否”)。
②该反应正反应的![]() ________(填“
________(填“![]() ”或“
”或“![]() ”)0。
”)0。
③当反应体系中![]() ,________(填“能”或“不能”)说明反应达平衡状态。
,________(填“能”或“不能”)说明反应达平衡状态。
④![]() ℃时该反应的平衡常数为________。
℃时该反应的平衡常数为________。
(3)工业上可以用![]() 溶液吸收
溶液吸收![]() ,并用电解法处理吸收后所得
,并用电解法处理吸收后所得![]() 溶液以实现吸收液的回收再利用(装置如图所示)。电源a端为________极,阳极的电极反应式为________。
溶液以实现吸收液的回收再利用(装置如图所示)。电源a端为________极,阳极的电极反应式为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/LNaOH溶液滴定10 mL 0.1 mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法不正确的是( )

A.A点溶液中加入少量水:![]() 增大
增大
B.B点:c( HA -)>c(H+)>c(A2一)>c(H2A)
C.C点:c(Na+) =c(HA-)+2c( A2-)
D.水电离出来的c(OH -):B点>D点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜![]() 含杂质
含杂质![]() 与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
![]() 溶液B经过________、__________、___________可得到氯化铜晶体;
溶液B经过________、__________、___________可得到氯化铜晶体;
![]() 检验溶液B中是否存在
检验溶液B中是否存在![]() 的方法是_________;
的方法是_________;
![]() 下列物质适合于调节溶液的pH得溶液B的是________
下列物质适合于调节溶液的pH得溶液B的是________
A.NaOH溶液 ![]()
![]() 氨水
氨水 ![]()
![]() 已知元素在高价态时常表现氧化性,若在酸性
已知元素在高价态时常表现氧化性,若在酸性![]() 溶液中加入一定量的
溶液中加入一定量的![]() 和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是____________
和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com