
分析 (1)Al核电荷数为13,具有3个电子层,最外层电子数为3,据此解答即可;
(2)钾性质较活泼,和水反应生成氢氧化钾和氢气,氢氧化钾能和氯化铝发生复分解反应;工业上采用电解Al2O3来制取Al,电解的阴极、阳极材料均由石墨材料做,因阳极上O2-失电子发生氧化反应生成O2,阴极铝离子得到电子发生还原反应生成铝;
(3)常温下Al的金属性比Ba的金属性弱,该反应是利用Ba的沸点比Al的低;
(4)(a)电子层数越多,半径越大,同样层数,核电荷数越大,半径越小;
(b)LiAlH4在125℃分解为LiH、H2和Al,据此书写方程式,计算产生Al的质量即可;
(c)依据失去电子,化合价升高为还原剂解答即可.
解答 解:(1)Al核电荷数为13,具有3个电子层,最外层电子数为3,核外电子排布式为:1s22s22p63s23p1,具有1s、2s、2p、3s、3p5种能量不同的电子,故答案为:3s23p1;5;
(2)钾是活泼金属,能和水反应生成氢氧化钾和氢气,氢氧化钾再和氯化铝溶液反应生成氢氧化铝,从而无法得到单质铝,用电解Al2O3来制取Al,电解的阴极、阳极材料均由石墨材料做,因阳极上O2-失电子发生氧化反应生成O2,阳极材料与该极上生成的O2反应被消耗,阴极铝离子得到电子发生还原反应生成铝,电极反应式为:Al3++3e-=Al,故答案为:钾先和水反应生成氢氧化钾,氢氧化钾再与氯化铝反应生成氢氧化铝,无法得到单质铝; Al3++3e→Al;
(3)利用元素Ba、Al在元素周期表的位置可知金属活泼性:Al<Ba;但Al在高温下可将氧化钡中钡置换出来,原因是Ba的沸点低于铝,高温时Ba转化为气体脱离反应体系,使反应正向进行,故答案为:利用Ba的沸点比Al的低,Ba以气体逸出,使平衡右移;
(4)(a)电子层数越多,半径越大,Al3+2层,故半径最大,H+最外层电子数为0,半径最小,因为Li+和H一电子层数相同,则核电荷数Li+比H一大,所以离子半径Al3+>H一>Li+>H+,故答案为:Al3+>H一>Li+>H+;
(b)LiAlH4在125℃分解为LiH、H2和Al,故化学反应方程式为:2LiAlH4 =2LiH+2Al+3H2↑,每生成3mol氢气,生成Al的质量为2×27=54g,此时生成3.36L氢气,即物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,故生成Al质量为:0.15mol×$\frac{2}{3}$=0.1mol,即2.7g,故答案为:2LiAlH4 =2LiH+2Al+3H2↑;2.7;
(c)LiAlH4与乙醛作用生成乙醇,碳元素的化合价由-1价变为-2价,则乙醛作氧化剂,LiAlH4中氢元素的化合价由-1价变为+1价,所以在该反应中LiAlH4作还原剂,
故答案为:还原剂.
点评 本题主要考查的是元素周期律的应用、电解池原理、氧化还原反应、方程式书写等,综合性较强,难度较大,注意整理.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 在稀硫酸中加人铜粉,铜粉不溶解;再加人NaNO3固体,铜粉仍不溶解 | |
| B. | 向明矾溶液中加人过量NaOH溶液会产生大量白色沉淀 | |
| C. | 除去FeCl3中少量的FeCl2,加人过量稀硝睃 | |
| D. | 浓硫酸、浓硝酸在加热条件下能将木炭氧化为二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸的物质的量浓度为9.2 mol/L | |
| B. | 1 mol Zn与足量该硫酸反应产生2 g氢气 | |
| C. | 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等质量的水混合后所得溶液的浓度大于9.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
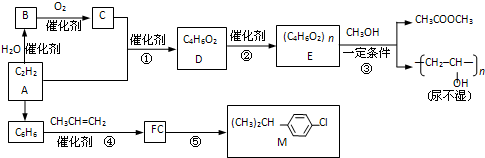
 .
. ,则R有4种.
,则R有4种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
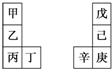 甲~辛等元素在周期表中的相对位置如表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A. | 丙与庚的原子序数相差3 | |
| B. | 气态氢化物的热稳定性:戊>己>庚 | |
| C. | 乙所在周期元素中,其简单离子的半径最大 | |
| D. | 乙的单质在空气中燃烧生成的化合物只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
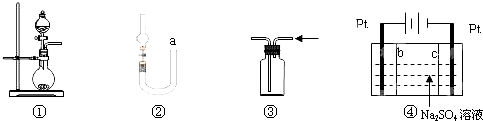
| A. | 图①可用于制取少量NH3或用MnO2和浓盐酸制取Cl2 | |
| B. | 可用从a处加水的方法检验图②装置的气密性 | |
| C. | 实验室可用图③的方法收集Cl2或NH3 | |
| D. | 利用图④装置制硫酸和氢氧化钠,其中c为阴离子交换膜、b为阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
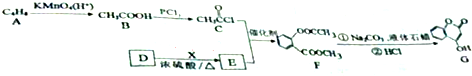
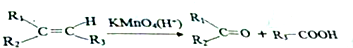
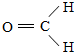 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H=2△H1+△H2+△H3 | B. | △H=△H1+△H2+△H3 | ||
| C. | △H=△H1+2△H2+2△H3 | D. | △H=2△H1+△H2-△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10属于烷烃的同分异构体有3种 | |
| B. | 分子组成是C5H10O2属于羧酸的同分异构体有5种 | |
| C. | 分子组成是C4H80属于醛类的同分异构体有3种 | |
| D. | 结构为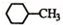 的一溴代物有5种 的一溴代物有5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com