

分析 辉铜矿加入氯化铁溶液溶解浸取过滤,得到矿渣加入苯水浴加热回收硫单质;加入在滤液中加入铁还原铁离子和铜离子过滤,滤液M中加入氯气氧化反应生成氯化铁循环使用,保温除铁加入稀硝酸溶液和氧化铜反应,调节溶液PH除去杂质离子,过滤得到滤液为硫酸亚铁溶液,在稀硝酸溶液中蒸发浓缩,冷却结晶过滤洗涤得到晶体,
(1)铁具有还原性,铁离子、铜离子具有氧化性,均可以与金属铁反应被还原,据此答题;
(2)苯沸点比较低,温度过高苯容易挥发,温度过低溶解速率小;
(3)NOx做还原剂,依据质量守恒和电子守恒写出方程式:4NOx+(5-2x)O2+2H2O=4HNO3,向滤液M中通入Cl2将FeCl2氧化为FeCl3,可以循环使用;
(4)Fe3++3H2O?Fe(OH)3+3H+,加入CuO使水解平衡正向进行,调节溶液的PH使铁元素完全转化为氢氧化铁沉淀;
(5)铜离子属于弱碱阳离子,容易水解呈酸性,加入酸可以抑制其水解,得到晶体的方法是蒸发浓缩溶液,冷却结晶,据此解答即可.
解答 解:(1)铁具有还原性,铁离子、铜离子具有氧化性,均可以与金属铁反应被还原,反应的离子反应方程式分别为:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Cu+Fe2+,
故答案为:Fe+2Fe3+=3Fe2+;Fe+Cu2+=Cu+Fe2+;
(2)苯沸点比较低,温度过高苯容易挥发,温度过低溶解速率小,
故答案为:温度高苯容易挥发;
(3)NOx做还原剂,依据质量守恒和电子守恒写出方程式:4NOx+(5-2x)O2+2H2O=4HNO3,HNO3可以循环使用,向滤液M中通入Cl2将FeCl2氧化为FeCl3,可以循环使用,故选b;
故答案为:HNO3;b;
(4)Fe3++3H2O?Fe(OH)3+3H+,加入CuO使水解平衡正向进行,调节溶液的PH使铁元素完全转化为氢氧化铁沉淀,
故答案为:调节溶液的pH,使Fe3+完全转化为Fe(OH)3沉淀;
(5)铜离子属于弱碱阳离子,容易水解呈酸性,加入酸可以抑制其水解,得到晶体的方法是蒸发浓缩溶液,冷却结晶,
故答案为:蒸发浓缩;冷却结晶.
点评 本题考查了物质分离提纯的方法和流程判断,主要是物质性质的理解应用和实验基本操作,掌握基础是关键,题目难度中等.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀就是金属失去电子被还原的过程 | |
| B. | 合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其成分金属强 | |
| C. | 铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e-=Fe3+,继而形成铁锈 | |
| D. | 将水库中的水闸(钢板)与外加直流电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

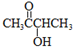 .
. CH3COO-+NH4++2Ag↓+3NH3+H2O.
CH3COO-+NH4++2Ag↓+3NH3+H2O. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210 | -253 | -78 |
| 沸点(℃) | -195 | -259 | -33 |
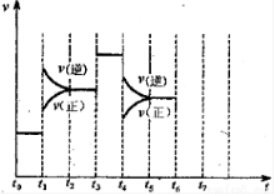
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 每生成0.6mol H2,被还原的水分子数目为1.2NA | |
| B. | 有2.7g Al参加反应时,转移的电子数目为0.3NA | |
| C. | 有6.72L H2生成时,反应中转移的电子数目为0.6NA | |
| D. | 溶液中每增加0.1mol AlO${\;}_{2}^{-}$,Na+的数目就增加0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{55}^{131}$I的化学性质与${\;}_{53}^{127}$I是相同 | |
| B. | ${\;}_{53}^{131}$I的原子序数为53 | |
| C. | ${\;}_{53}^{131}$I的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}$I的原子核内中子数多于质子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用过滤的方法分离FeCl3溶液和Fe(OH)3胶体 | |
| B. | Fe(OH)3胶体静置会分层 | |
| C. | HCl、SO2、Fe2+均既有氧化性又有还原性 | |
| D. | CH3COONH4的电离方程式为:CH3COONH4 CH3COO-+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该电池与硅太阳能电池供电原理相同 | |
| B. | 光照时,b极周围pH减小 | |
| C. | 光照时,H+由b极室透过质子膜进入a极室 | |
| D. | 夜间无光照时,a为电池的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液能导电,所以氯化钠溶液是电解质 | |
| B. | NaCl固体不导电,熔融的KCl能导电,所以前者是非电解质,而后者是电解质 | |
| C. | SO2、Na2O的水溶液都能导电,所以它们都是电解质 | |
| D. | 在溶于水或熔融状态下能够自身发生电离的化合物一定是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com