
| pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
分析 (1)反应为O3氧化I-生成I2,根据盖斯定律①+②+③可得总反应以及△H;
(2)①根据v=$\frac{△c}{△t}$计算;
②pH增大,则OH-浓度增大;
③根据pH和温度判断达到平衡所用的时间的范围,可判断分解速率;
(3)A.由图温度越高K值越小,反应I2(aq)+I-(aq)?I3-(aq)的△H<0
B.硫难溶于水,而碘单质与I-形成I3-而溶于水,可以达到除去少量碘的目的;
C.加入苯,碘能溶于苯,这样水中碘的浓度变小,平衡向逆左移动;
D.平衡常数只受温度影响,与物质的浓度无关;
(4)①上层溶液是碘化钾的水溶液,存在平衡I2(aq)+I-(aq)?I3-(aq),中含碘元素的微粒有I-、I2、I3-;
②由实验现象可推测关于I2溶解性的结论是在此温度下,I2在KI溶液中的溶解性比在CCl4中强.
解答 解:(1)将所给的三个反应:①+②+③可得总反应:2I-(aq)+O3(g)+2H+(aq)=I2(aq)+O2(g)+H2O(l),△H=△H1+△H2+△H3,
故答案为:O3(g)+2I-(aq)+2H+(aq)═I2(aq)+H2O(l)+O2(g)△H=△H1+△H2+△H3;
(2)①v=$\frac{△c}{△t}$=$\frac{0.0108mol/L}{108min}$=1.00×10-4mol/(L•min),故答案为:1.00×10-4;
②pH增大,则OH-浓度增大,pH增大能加速O3分解,表明对O3分解起催化作用的是OH-,故答案为:OH-;
③由表中数据可知,40°C、pH=3.0时,所需时间在31min~158min之间;
10°C、pH=4.0时,所需时间>231min;
30°C、pH=7.0时,所需时间<15min,则分解速率依次增大的顺序为b、a、c,
故答案为:b、a、c.
(3)A.由表中数据可知,温度越大平衡常数越小,说明升高温度平衡向逆反应方向移动,故正反应方向为放热反应,即△H<0,故A错误;
B.硫难溶于水,而碘单质与I-形成I3-而溶于水,可以达到除去少量碘的目的,故B正确;
C.加入苯,碘能溶于苯,这样水中碘的浓度变小,平衡向逆左移动,故C错误;
D.加入KI固体,平衡向右移动,但平衡常数只受温度影响,与物质的浓度无关,加入少量KI固体,平衡常数K不变,故D错误;
故选B;
(4)①上层溶液是碘化钾的水溶液,存在平衡I2(aq)+I-(aq)?I3-(aq),中含碘元素的微粒有I-、I2、I3-,故答案为:I-、I2、I3-;
②由实验现象可推测关于I2溶解性的结论是在此温度下,I2在KI溶液中的溶解性比在CCl4中强,故答案为:在此温度下,I2在KI溶液中的溶解性比在CCl4中强.
点评 本题考查化学反应速率的影响因素的实验探究,和温度对化学平衡的影响、化学平衡常数及影响元素,难度不大,注意对基础知识的理解掌握..


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 碱性锌锰电池是二次电池 | |
| B. | 铅蓄电池是二次电池 | |
| C. | 二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生 | |
| D. | 燃料电池的活性物质没有储存在电池内部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
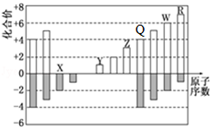
| A. | 原子半径:Z>Y>X | |
| B. | X和Z形成的化合物能溶于NaOH溶液 | |
| C. | Q和X形成的化合物不能与酸反应 | |
| D. | R元素的含氧酸和W元素的含氧酸,酸性一定前者强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验及现象 | 结论 |
| A | 将湿润的红色石蕊试纸放在试管口,试纸变蓝 | 反应中有NH3产生 |
| B | 收集产生的气体并点燃,火焰呈淡蓝色 | 反应中有H2产生 |
| C | 收集气体的同时测得溶液的pH为8.6 | 溶液中OH?氧化了Mg |
| D | 将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生 | 弱碱性溶液中Mg也可被氧化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
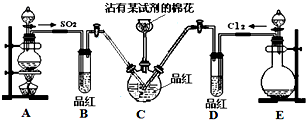 探究SO2和氯水的漂白性,设计了如下实验,装置如图.
探究SO2和氯水的漂白性,设计了如下实验,装置如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g | B. | 11.2 g | C. | 22.4 g | D. | 20.16 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com