
【题目】如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为V L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+ 2B(g)![]() C(g)
C(g)![]() +2D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
+2D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
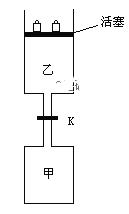
(1)乙中B的转化率为______________;
(2)甲中D和乙中C的物质的量比较:__________(填“相等”、“前者大”、“后者大”);
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为________(用含V的代数式表示,连通管中气体体积忽略不计)。
【答案】(6分)
(1)20%(2分) (2)后者大 (2分) (3)0.29V(2分)
【解析】
试题(1)设到达平衡时乙容器中B的物质的量减少xmol,
3A(g)+ 2B(g)![]() C(g)
C(g)![]() +2D(g)
+2D(g)
开始(mol) 3 7
消耗(mol) 1.5x x 0.5x x
平衡(mol) 3-1.5x 7-x 0.5x x
根据恒温恒压下,气体的体积之比等于物质的量之比,则(3-1.5x+7-x+0.5x+x)/(3+7)=0.86V/V,解得x=1.4,则B的转化率是1.4mol/7mol×100%=20%;
(2)甲是恒温恒容条件,达平衡时压强减小,若乙与甲的浓度相同时,以为乙是恒温恒压条件,所以甲需增大压强到达乙的平衡状态,而增大压强,平衡正向移动,恒压下的C、D的物质的量都比恒温下的C、D的物质的量多;而实际乙容器中的浓度是甲的2倍,所以乙中C、D的物质的量比甲容器中C、D物质的量的2倍还多,甲容器中,D物质的量是C的2倍,所以乙中C的物质的量比甲中C的2倍还多,也即比甲中的D的物质的量大,所以甲中D和乙中C的物质的量比较,后者大;
(3)打开K,整体是恒温恒压条件,此时A的物质的量是4.5mol,B的物质的量是10.5mol,与乙容器中的A:3mol,B:7mol对应成比例,整体容器的各物质的物质的量是原来乙容器的1.5倍,所以达到的新平衡与乙容器达到的平衡是等效平衡,总体积是原平衡时乙容器的1.5倍,即新平衡时容器的总体积是0.86VL×1.5=1.29VL,甲容器的体积是VL,所以此时乙容器的体积是1.29V-V=0.29VL。


科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关.
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水法收集反应放出的氢气,实验记录如下(累计值):
时间 | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标况) | 100 | 240 | 464 | 576 | 620 |
①哪一段时间内反应速率最大:____min(填“0~1”“1~2”“2~3”“3~4”或“4~5”)。
②3~4min内以盐酸的浓度变化来表示的该反应速率______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积.他事先在盐酸中加入等体积的下列溶液以减慢反应速率但不影响生成氢气的量.你认为不可行的是____(填字母)。
A 蒸馏水 B KCl洛液 C 浓盐酸 D CuSO4溶液
(3)在4L密闭容器中,X、Y、Z三种气体的物质的量随时间变化曲线如图。

①该反应的化学方程式是_______________。
②该反应达到平衡状态的标志是___________(填字母)。
A Y的体积分数在混合气体中保持不变 B X,、Y的反应速率比为3:1
C 容器内气体压强保持不变 D 容器内气体的总质量保持不变
E 生成1molY的同时消耗2molZ
③2min内Y的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,相关示意图像错误的是
A | B | C | D |
将二氧化硫通入到 一定量氯水中 | 将氨水滴入到一定量氯化铝溶液中 | 将铜粉加入到一定量 浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态有机物X含C、H、O三种元素,已知下列条件,现欲确定X的分子式,所需最少条件是 ( )
①X中含碳质量分数 ②X中含氢质量分数③X在标准状况下的体积 ④X对H2的相对密度⑤X的质量
A.①②B.①②④
C.①②⑤D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,它们之间有如下转化关系:
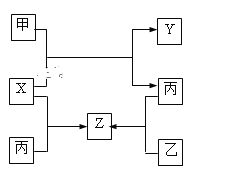
⑴若甲是短周期金属单质,乙、丙是短周期非金属单质,X、Y、Z中只有一种是离子晶体, 试推断:
①X的电子式是______________________________。
②X与甲反应的化学方程式______________________________________________。
⑵若甲是气体单质,丙通常是液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子,试推断:
①写出Z的化学式_______________________。
②写出X与足量的甲在溶液中完全反应的离子方程式:_________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5 mL 0.005 mol/L FeCl3溶液和5 mL 0.015 mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:
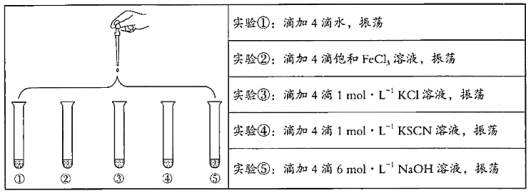
下列说法不正确的是
A. 对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B. 对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动
C. 对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D. 对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
(1)在密闭容器中充入NH3和CO2 ,一定条件能自发进行的原因是__________________;
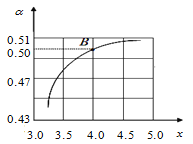
(2)T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)![]() =x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是_________________;
=x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是_________________;
(3)当x=2,上述反应至5min时各物质的浓不再发生变化,若起始的压强为P0 KPa,测得平衡体系压强变为起始时的![]() 。反应结束后,分离得到90g尿素。
。反应结束后,分离得到90g尿素。
试计算该反应的平均速率v(CO2)=___________________,
该反应的平衡常数(K)=________________,
达到平衡后NH3的物质的量浓度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家通过测量SiO2中26 Al和10 Be两种元素的比例来确定“北京人”的年龄,这种测量方法叫铝铍测年法。下列关于26 Al和10 Be的说法不正确的是( )
A. 10 Be和9 Be是中子数不同、质子数相同的不同原子
B. 10 Be原子核内的中子数比质子数多
C. 5.2g 26 A13+中所含的电子数约为1.2![]() 1023
1023
D. 26AI和26 Mg的质子数、中子数和核外电子数都不相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com