
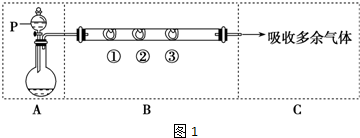
分析 装置A:由浓硫酸和浓盐酸混合制取HCl气体,因浓硫酸稀释时,发出热量,使盐酸中的氯化氢气体挥发制氯化氢,所以应将浓硫酸缓慢加入到浓盐酸中;装置B:①通过①后生成了Cl2,KMnO4氧化HCl得到Cl2,KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,②蘸有KI溶液,有棕黄色物质确定为单质碘,氯气能与碘化钾反应生成单质碘,方程式为:Cl2+2KI=2KCl+I2,③蘸有石蕊溶液,Cl2能与水反应生成HCl和HClO,HCl具有酸性,能使石蕊溶液变红,HClO具有强氧化性能使红色褪去.
(1)根据仪器的特征及其常用仪器的名称解答;
(2)由通过①后生成了Cl2,KMnO4能氧化HCl得到Cl2,有棕黄色物质确定为单质碘,卤素单质间能发生置换反应,Cl2能与水反应生成HCl和HClO,HCl具有酸性和HClO具有强氧化性;
(3)①剩余气体的主要成分,可能为氯气或氯化氢或两者的混合物,实验过程中,观察到装置D处有棕黄色物质产生,验证剩余气体中含有氯气;
②装置F的烧杯中加入适量AgNO3溶液,氯离子和银离子反应生氯化银;
③气体中的氯气和铜反应后剩余,通入F装置中也会生成氯化银白色沉淀,影响氯化氢的检验,需要在通入硝酸银溶液前检验是否有氯气的存在,广口瓶中试剂可以利用氯气的氧化性,选择淀粉碘化钾溶液,也可以放入湿润的有色布条,依据氯气和水反应的次氯酸的漂白性进行分析验证,所以此试剂的作用为除尽氯化氢气体中的氯气,排除氯气影响氯化氢的检验.
解答 解:(1)仪器P具有球形特征,且有玻璃活塞,为分液漏斗,
故答案为:分液漏斗;
(2)因通过①后生成了Cl2,而KMnO4溶液能氧化HCl得到Cl2,所以①处包有的某固体物质可能是KMnO4,有棕黄色物质确定为单质碘,卤素单质间能发生置换反应:Cl2+2KI=2KCl+I2,因Cl2能与水反应生成HCl和HClO,HCl具有酸性,能使石蕊溶液变红,HClO具有强氧化性能使红色褪去,
故答案为:b;先变红后褪色;
(3)①剩余气体的主要成分,可能为氯气或氯化氢或两者的混合物,氯化氢与铜不反应,铜和氯气反应生成棕黄色的氯化铜,若剩余气体中含有氯气,实验过程中,装置D有棕黄色固定产生,
故答案为:验证剩余气体中含有氯气;
②剩余气体的主要成分,可能为氯气或氯化氢或两者的混合物,溶于水,水中含有氯离子,氯离子和银离子反应:Ag++Cl-=AgCl↓,有白色沉淀产生,
故答案为:有白色沉淀产生;
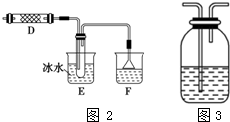
③乙同学认为甲同学的实验有缺陷,不能证明最终通入AgNO3溶液的气体中不含氯气.气体中的氯气和铜反应后剩余,通入F装置中也会生成氯化银白色沉淀,影响氯化氢的检验,需要在通入硝酸银溶液前检验是否有氯气的存在,广口瓶中试剂可以利用氯气的氧化性,选择淀粉碘化钾溶液,也可以放入湿润的有色布条,依据氯气和水反应的次氯酸的漂白性进行分析验证,为了确保实验的可靠性,乙同学提出在E、F之间加装图2所示装置中可以放淀粉碘化钾溶液,若变蓝色证明含有氯气,否则不含;或放入湿润的有色布条,若不褪色证明无氯气存在,否则证明含有,BD无变化现象不能证明,所以选择AC,此试剂的作用为除尽氯化氢气体中的氯气,排除氯气影响氯化氢的检验.
故答案为:E;F;AC;除尽氯化氢气体中的氯气.
点评 本题考查了实验室制备氯气的实验分析和性质验证,产物验证实验的设计分析应用,能够根据实验现象判断物质的性质,离子反应的现象分析判断是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/1000kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
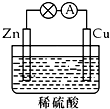
| A. | 铜极上发生氧化反应 | B. | 正极反应为:Cu-2e-=Cu2+ | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 反应一段时间后,溶液的酸性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molNaOD溶于重水制成1L溶液,pD=13 | |
| B. | 将pD=4的DCl的重水溶液稀释100倍,所得溶液pD不等于6 | |
| C. | 向30mL0.5mol•L-1NaOD的重水溶液中加入20mL0.5mol•L-1DCl的重水溶液,所得溶液pD=11 | |
| D. | pD=10的NaOD的重水溶液中,由重水电离出的c(OD-)为1×10-10mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每个53131Cs含有78个中子 | B. | CsOH的碱性比KOH的强 | ||
| C. | HI的还原性比HF的强 | D. | KIO3是碘的最高价含氧酸的盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷元素的最高化合价为+3 | B. | 砷元素是第四周期第VA族的元素 | ||
| C. | 砷原子的M电子层有8个电子 | D. | 砷的氧化物的水溶液呈强碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石油裂解、煤的气化、海水制镁等过程中都包含化学变化 | |
| B. | 可通过电解熔融MgCl2来制取金属镁,故也能通过电解熔融AlCl3来制取铝 | |
| C. | 铝热剂、盐酸、水玻璃、双氧水、明矾均为混合物 | |
| D. | Na2O2、NaOH、NH4Cl均为含共价键的离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
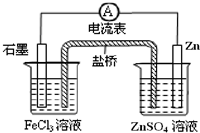 根据下列原电池示意图,回答下列问题:
根据下列原电池示意图,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com