

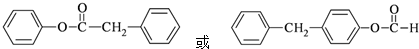
 .
. $→_{Pd/C}^{H_{2}}$
$→_{Pd/C}^{H_{2}}$ .化合物
.化合物  是合成抗癌药物美发伦的中间体,请写出以
是合成抗癌药物美发伦的中间体,请写出以  和
和 为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:分析 合成H的各物质都在合成图中,由碳链骨架和官能团的变化可知,反应①为取代反应,反应②为还原反应,反应③为取代反应,反应④为加成反应,反应⑤为取代反应;
(1)根据以上分析判断反应类型;
(2)B为 ,其一种同分异构体满足I.分子中含有两个苯环;II.分子中有7 种不同化学环境的氢;Ⅲ.不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应,则该有机物中不含酚羟基,含2个苯环及酯的结构,且水解后生成苯酚结构;
,其一种同分异构体满足I.分子中含有两个苯环;II.分子中有7 种不同化学环境的氢;Ⅲ.不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应,则该有机物中不含酚羟基,含2个苯环及酯的结构,且水解后生成苯酚结构;
(3)以  和
和 为原料制备
为原料制备 ,可以用
,可以用 先发生硝化反应生成硝基苯,再还原为苯胺,然后与
先发生硝化反应生成硝基苯,再还原为苯胺,然后与 反应生成的物质,该物质再与SOCl2在加热条件下反应得到产物.
反应生成的物质,该物质再与SOCl2在加热条件下反应得到产物.
解答 解:合成H的各物质都在合成图中,由碳链骨架和官能团的变化可知,反应①为取代反应,反应②为还原反应,反应③为取代反应,反应④为加成反应,反应⑤为取代反应;
(1)根据以上分析可知①③⑤为取代反应,
故答案为:①③⑤;
(2)B为 ,其一种同分异构体满足I.分子中含有两个苯环;II.分子中有7 种不同化学环境的氢;III.不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应,则该有机物中不含酚羟基,含2个苯环及酯的结构,且水解后生成苯酚结构,符合条件的同分异构体为
,其一种同分异构体满足I.分子中含有两个苯环;II.分子中有7 种不同化学环境的氢;III.不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应,则该有机物中不含酚羟基,含2个苯环及酯的结构,且水解后生成苯酚结构,符合条件的同分异构体为 ,
,
故答案为: ;
;
(3)以  和
和 为原料制备
为原料制备 ,可以用
,可以用 先发生硝化反应生成硝基苯,再还原为苯胺,然后与
先发生硝化反应生成硝基苯,再还原为苯胺,然后与 反应生成的物质,该物质再与SOCl2在加热条件下反应得到产物,则合成路线流程图为
反应生成的物质,该物质再与SOCl2在加热条件下反应得到产物,则合成路线流程图为 ,
,
故答案为: .
.
点评 本题考查有机物的合成,明确合成图中物质的结构与性质的关系、碳链结构与官能团的变化等即可解答,题目难度中等,(3)为解答的难点,注意结合信息来分析解答.


科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取等量的硝酸铜,需硝酸的量②最少 | |
| B. | 制取等量的硝酸铜,②产生的有毒气体比①少 | |
| C. | 三种方案中,硝酸的利用率为③>①>② | |
| D. | 三种方案的反应都可以在铁质容器中进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 (弱碱性,易被氧化)
(弱碱性,易被氧化) 中官能团的名称氨基、羧基,②的反应类型是取代反应.
中官能团的名称氨基、羧基,②的反应类型是取代反应. 的同分异构体的结构简式
的同分异构体的结构简式 .
. +nH2O.
+nH2O. 的合成路线.
的合成路线.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com