
【题目】某化学实验小组用酸性KMnO4溶液和草酸(H2C2O4)溶液反应,研究外界条件反应速率的影响,设计了如下探究实验方案:
实验 | 草酸溶液 (0.5mol/L) | 高锰酸钾 (0.5mol/L) | 稀硫酸 (0.5mol/L) | 硫酸锰 (0.5mol/L) | 温度 | 蒸馏水 |
① | 10.0 mL | 2.0 mL | 3.0 mL | 0 | 25℃ | 1.0 mL |
② | 10.0 mL | 2.0 mL | 3.0 mL | 1.0 mL | 25℃ | 0 |
③ | 8.0 mL | 2.0 mL | 3.0 mL | 0 | 25℃ | Vx |
④ | 10.0 mL | 2.0 mL | 3.0 mL | 0 | 35℃ | 1.0 mL |
回答下列问题:
(1)本方案中用于设计实验的化学反应的离子方程式是____,实验中预计通过观察什么现象或测定什么数据来进行判断:_____。
(2)该实验的目的是____。
(3)实验③中的Vx=____;实验①和④测得反应速率分别为v1、v4,则v1____v4(填:“>”“<”和“=”)
(4)实验①中,c(Mn2+)与t关系如图所示。AB段斜率明显大于OA段斜率,除反应可能放热外,猜想还可能是_____,利用提供的试剂设计实验III,验证猜想。
提供的试剂:0.01mol/L酸性KMnO4溶液,0.1 mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
①补全实验III的操作:向试管中先加入1mL 0.01mol/L酸性KMnO4溶液,再加入10滴3mol/L硫酸,然后加入少量的____,最后加入1mL 0.1 mol/L草酸溶液。
②若猜想成立,应观察到的实验现象是_______。

【答案】2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 观察溶液紫红色褪去的快慢(或测定从反应开始至溶液紫红色褪去所用时间) 研究反应物浓度、催化剂(或Mn2+的催化作用)、温度对化学反应速率的影响 3.0 < 产物中的Mn2+对该反应有催化作用 MnSO4固体 加入草酸溶液后,溶液紫色迅速变浅
【解析】
(1)实验中酸性高锰酸钾溶液氧化草酸,据此书写反应的离子方程式;酸性高锰酸钾溶液为紫红色,实验中可通过观察溶液紫红色褪去的快慢或测定从反应开始至溶液紫红色褪去所用时间判断反应速率;
(2)结合表中数据分析判断该实验的目的;
(3)实验①和实验③中只有草酸的浓度不同,所以探究草酸浓度对反应速率的影响,因此溶液的体积应该相同;实验①和实验④中温度不同,温度越高,反应速率越快,据此判断v1、v4大小;
(4)由于生成物中有锰离子产生,还可能是产物中的Mn2+对该反应有催化作用。设计实验验证猜想时,可以加入MnSO4固体与实验II对比,若猜想成立,加入MnSO4固体溶液紫色应迅速变浅,据此分析解答。
(1)实验中酸性高锰酸钾溶液氧化草酸,反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;由于酸性高锰酸钾溶液为紫红色,所以实验中可通过观察溶液紫红色褪去的快慢或测定从反应开始至溶液紫红色褪去所用时间来判断反应速率,故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;观察溶液紫红色褪去的快慢(或测定从反应开始至溶液紫红色褪去所用时间);
(2)结合表中数据可知,该实验的目的是研究反应物浓度、催化剂(或Mn2+的催化作用)、温度对化学反应速率的影响,故答案为:研究反应物浓度、催化剂(或Mn2+的催化作用)、温度对化学反应速率的影响;
(3)实验①和实验③中只有草酸的浓度不同,所以探究草酸浓度对反应速率的影响,因此溶液的体积应该相同,则实验③中的Vx=3.0;实验①和实验④中温度不同,温度越高,反应速率越快,则v1<v4,故答案为:3.0;<;
(4)由于生成物中有锰离子产生,所以AB段斜率明显大于OA段斜率,除了反应可能放热外,还可能是产物中的Mn2+对该反应有催化作用,故答案为:产物中的Mn2+对该反应有催化作用;
①要验证该反应中生成的Mn2+对反应有催化作用,可以通过加入MnSO4固体与实验II对比,其他条件与实验II相同,故实验Ⅲ的操作为:向试管中先加入1mL0.01mol/L酸性KMnO4溶液,再加入10滴3mol/L硫酸,然后加入少量MnSO4固体,最后加入1mL0.1mol/L草酸溶液,故答案为:MnSO4固体;
②若猜想成立,则实验III褪色迅速,可以观察到:加入草酸溶液后,溶液紫色迅速变浅,故答案为:加入草酸溶液后,溶液紫色迅速变浅。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
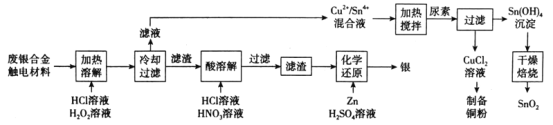
【题目】对废银合金触电材料进行分离回收既节约矿物资源,又可以减少环境污染。某废银合金触电材料含Ag、Cu、Sn等,现欲利用以下工艺流程回收其中的金属资源。
回答下列问题:
(1)“加热溶解”时Cu发生的离子方程式为_________。
(2)“加热溶解”时温度常控制在50℃左右,温度不宜过高也不宜过低的原因为_________。
(3)“酸溶解”过程中会产生少量遇空气变为红棕色的无色气体,则“酸溶解”过程主要的化学方程式为_____________。
(4)常温下,Cu2+/Sn4+混合液中c(Cu3+)=0.022mol·L-1,将混合液“加热搅拌”后冷却至室温,再加“尿素”调节溶液的pH范围为__________。(当溶液中的离子浓度小于10-5mol·L-1时,沉淀完全,已知:Ksp[Sn(OH)4]=1×10-55;Ksp[Cu(OH)2]=2.2×10-20)
(5)检验Sn(OH)4沉淀是否洗涤干净的方法是____________。
(6)用惰性电极电解CuCl2溶液,阴极反应式是___________,若想由CuCl2溶液得到无水CuCl2固体,则需进行的实验操作为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒及其化合物在工业生产中有着广泛的应用,可作为制硫酸的催化剂,从含钒废料(含有V2O5、V2O4、SiO2、Fe2O3等)中回收V2O5的流程如下:
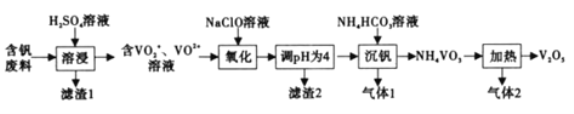
巳知:NH4VO3微溶于冷水,易溶于热水,不溶于乙醇。
回答下列问题:
(1)为提高浸出速率,除适当増加硫酸浓度外,还可采取的措施有______(写出一条),滤渣1的成分是_____________,酸浸时V2O4发生反应的离子方程式为_______________。
(2)“氧化反应”反应中还原剂与氧化剂的物质的量之比为______。
(3)该流程中可循环利用的物质有______(填化学式)。
(4)已知![]() +2H+
+2H+![]()
![]() +H2O,沉钒”过程中,主要反应的离子方程式为______。沉钒后为了得到尽可能多的NH4VO3,需要进行的主要操作有:冷却过滤、___________。
+H2O,沉钒”过程中,主要反应的离子方程式为______。沉钒后为了得到尽可能多的NH4VO3,需要进行的主要操作有:冷却过滤、___________。
(5)钒电池是目前发展势头强劲的优秀绿色环保电池,全钒液流储能电池就是其中一种,它的正负极活性物质形成的电解质溶液相互分开,该电池采用石墨电极,其工作原理示意如图。放电时正极反应式为_____,充电时质子的移动方向为_____(填“从左向右”或“从右向左”)。
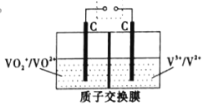
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4)是一种易分解、易水解的白色固体、难溶于CCl4。实验室可将干燥二氧化碳和氨气通入CCl4中进行制备,反应原理为2NH3(g)+CO2(g)=NH2COONH4(s) △H<0,回答下列问题:
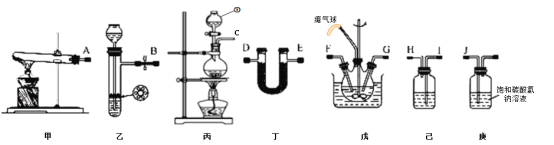
(1)仪器①的名称为_____,装置己中盛放的试剂为_____。
(2)简述检验装置乙气密性的操作_____。
(3)氨气的发生装置可以选择上图中的_____,制取氨气的化学方程式为_____。
(4)预制备产品,选择上图中必要的装置,其连接顺序为:发生装置→_____→FG←_____←KJ←_____(按气流方向,用大写字母表示)。
(5)为了提高氨基甲酸铵的产率.对三颈瓶采取的控温方法是_____,反应结束后,从反应后的混合物中分离出产品的实验操作是_____,戊中气球的作用是_____。
(6)氨基甲酸铵容易变质生成碳酸氢铵,现取长期存放的样品19.550g,用足量石灰水处理后,使样品中碳元素完全转化为碳酸钙,通过系列操作得纯净碳酸钙25.000g,则该样品的纯度为_____%。(计算结果保留三位有效数字;有关物质的相对式量:氨基甲酸铵78、碳酸氢铵79、碳酸钙100) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni(OH)2作为合成镍钴锰三元电极材料的原料,工业上可用红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2)制备,工艺流程如图所示。回答下列问题:

(1)“滤渣1”的成分为______(写化学式)。
(2)“除铁”中,加入NaClO的目的是_________________,为了证明加入NaClO已足量,可选择的试剂是__________ (填字母标号)。
a.KSCN溶液、氯水 b.K3[Fe(CN)6]溶液 c.NaOH溶液
(3)已知“滤渣2”的成分为黄钠铁矾,其化学式为NaFe3(SO4)2(OH)6,则“除铁”
中“Na2CO3/△”条件下生成滤渣2的离子方程式为_______________。
(4)“除镁”中,若溶液pH过小,Mg2+沉淀不完全,原因是_____________。
(5)“沉镍”的离子方程式为__________。
(6)以镍钴锰三元材料(可简写为Li1-nMO2)为一极电极材料的新型锂电池工作原理如图所示,放电时总反应为Li1-nMO2+LinC6 ![]() LiMO2+6C,则充电时b极的电极反应式为____________________。
LiMO2+6C,则充电时b极的电极反应式为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaBiO3为浅黄色或褐色沉淀。NaBiO3与硝酸酸化的MnSO4溶液发生反应:5NaBiO3+2Mn2++14H+=2MnO![]() +5Bi3++5Na++7H2O。下列推断正确的是
+5Bi3++5Na++7H2O。下列推断正确的是
A.上述反应中的MnSO4溶液也可以用盐酸或硫酸酸化
B.可用BiO![]() 检验Na+的存在
检验Na+的存在
C.由上述反应可知氧化性:NaBiO3>HNO3>KMnO4
D.NaBiO3与浓盐酸反应的离子方程式为:NaBiO3+2Cl-+6H+=Bi3++Na++3H2O+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.1molCl2与足量铁反应,转移电子数为2NA
B.3.0g含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA
C.65gZn与适量浓硫酸完全反应所得混合气体的分子数为NA
D.1L0.1 mol/L 盐酸中含H+数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是
A.100 g46%的甲酸水溶液中所含的氧原子数目为 5NA
B.常温下,1L pH=7 的 lmolL-1 CH3COONH4 溶液中 CH3COO-与![]() 数目均为NA
数目均为NA
C.11 g由![]() H和
H和![]() O组成的超重水中,含有的中子数目为 5NA
O组成的超重水中,含有的中子数目为 5NA
D.高温下 ,5.6gFe 与足量的水蒸气反应,转移电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(1)被氧化的元素是_________,被还原的元素是________;
(2)氧化剂与还原剂的物质的量之比是_________________;
(3)用双线桥法分析上述反应的电子转移方向和数目____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com