
砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)  2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为________;砷酸的第一步电离方程式为_____________。
(2)“一级沉砷”中FeSO4的作用是___________;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_____________。
(3)沉淀X为___________(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的 最低检出限为3.0×10-6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
(4)AsH3的电子式为_______________。
(5)步骤2的离子方程式为_________________。
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10-5g·kg-1,请通过计算说明该排放的废渣中砷元素的含量_______(填“符合”、“不符合”)排放标准,原因是__________
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年江苏省扬州市高二下学期学业水平测试(二)化学试卷(解析版) 题型:选择题
酚酞是一种常用的酸碱指示剂,其结构简式如下图所示,酚酞属于
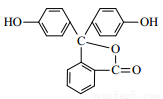
A. 氧化物 B. 碱 C. 有机物 D. 无机物
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三下学期周练(2)化学试卷(解析版) 题型:选择题
A. 某温度时,化学反应速率无论用A、B、C何种物质表示,其数值是相同的
B. 其他条件不变,增大压强,反应速率加快
C. 若增加或减小B的物质的量,则反应速率一定会发生明显的变化
D. 其他条件不变,升高温度,反应速率加快
查看答案和解析>>
科目:高中化学 来源:2017届四川省成都市高三二诊模拟考试理综化学试卷(解析版) 题型:实验题
黄铜矿不仅可用于火法炼铜,也可用于湿法炼铜,湿法可同时生产铜、磁性氧化铁和用于橡胶工业的一种固体物质A,流程如下:
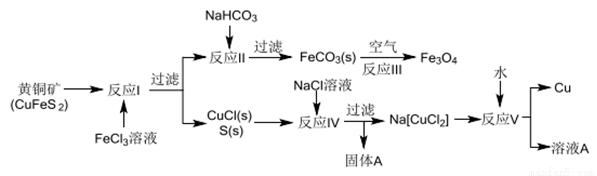
(1)黄铜矿中Cu 的化合价是______,反应I中65gFeC13 可氧化________mol CuFeS2。
(2)工业生产中的过滤操作多采用倾析法分离出固体物质,下列适合用倾析法的有______。
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)在反应Ⅱ中,计算NaHCO3饱和溶液(其中CO32-平衡浓度为1.2×10-3mol/L)可产生FeCO3沉淀时的最小Fe2+浓度是_________(己知FeCO3的Ksp=3.0×10-11)
(4)反应Ⅲ是在设备底部鼓入空气,高温氧化锻烧法来制备磁性氧化铁,写出对应的化学方程式_________________。
(5)固体物质A的成分________(写名称)。
(6)潮湿的FeCO3固体若不及时灼烧处理会在空气中逐渐变红,写出相关的化学方程式:_______________。
(7)本流程中可实现循环使用的物质除了水外,还有_____________。
查看答案和解析>>
科目:高中化学 来源:2017届四川省成都市高三二诊模拟考试理综化学试卷(解析版) 题型:选择题
下列关于有机物的说法正确的是( )
A. 糖类、油脂和蛋白质都是人体必需的营养物质,都属于高分子化合物
B. 乙醇、乙酸均能与NaOH反应.是因为分子中均含有官能团“-OH”
C. 分子式为C6H12且碳碳双键在链端的烯烃共有6种异构体
D. 分子式为C4H7ClO2的羧酸可能有5种
查看答案和解析>>
科目:高中化学 来源:2017届山东省泰安市高三第一轮复习质量检测(一模)理科综合化学试卷(解析版) 题型:选择题
一种以NaBH4和H2O2为原料的新型电池的工作原理如图所示。下列说法错误的是
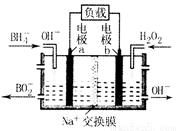
A. 电池的正极反应为H2O2+2e-==2OH-
B. 电池放电时Na+从a极区移向b极区
C. 电子从电极b经外电路流向电极a
D. b极室的输出液经处理后可输入a极室循环利用
查看答案和解析>>
科目:高中化学 来源:2017届湖南省邵阳市高三第二次大联考理综化学试卷(解析版) 题型:简答题
三盐(3PbO·PbSO4·H2O)可用作聚氯乙烯的热稳定剂,200℃以上开始失去结晶水,不溶于水及有机溶剂。以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如图所示。
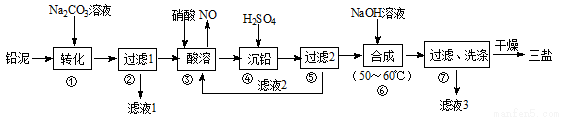
已知:PbSO4和PbCO3的溶解度和溶度积Ksp如下表。
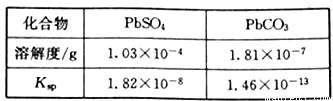
(1)步骤①转化的目的是_______,滤液1中的溶质为Na2CO3和_______(填化学式)。
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是_________(任写一条)。其中铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为__________________。
(3)滤液2中可循环利用的溶质的化学式为_______。若步骤④沉铅后的滤液中c(Pb2+)=1.82×10-5mol/L,则此时c(SO42-)=______mol/L。
(4)步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是________________。
(5)步骤⑥合成三盐的化学方程式为____________,若得到纯净干燥的三盐99.Ot,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为________。
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三下学期第二次质量监测理综化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A. PH=6的溶液一定显酸性
B. 25℃时,0.1mol/L的NaHB溶液呈酸性,说明H2B为强酸
C. NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用
D. 0.1mol/LCH3COOH溶液与0.05mol/LNaOH溶液等体积混合,所得溶液中:2c(Na+)═c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二3月学业水平测试化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,16 gO2中含有的氧分子数为NA
B. 1 molOH-中含有的电子数为10NA
C. 标准状况下,11.2 L H2O中含有的氢原子数为NA
D. 1 mol/LBaCl2溶液中含有的钡离子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com