
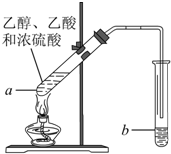
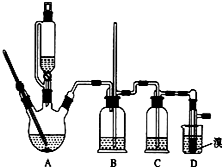
 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.分析 乙醇与乙酸在浓硫酸做催化剂、吸水剂条件下反应生成乙酸乙酯,为防止液体加热发生爆沸应加入少量碎瓷片,为防止发生倒吸,则装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,乙醇、乙酸易挥发,制备的乙酸乙酯中含有乙醇和乙酸,乙醇易溶于水,乙酸能够与碳酸钠溶液反应,乙酸乙酯在饱和碳酸钠溶液中溶解度不大,所以可以用饱和碳酸钠溶液除去乙醇、乙酸,降低乙酸乙酯的溶解度,分离两种互不相溶的液体用分液方法,据此解答.
解答 解:(1)乙醇与乙酸在浓硫酸做催化剂、吸水剂条件下反应生成乙酸乙酯,为防止液体加热发生爆沸应加入少量碎瓷片;
故答案为:防止爆沸;
(2)乙醇、乙酸易挥发,制备的乙酸乙酯中含有乙醇和乙酸,乙醇易溶于水,乙酸能够与碳酸钠溶液反应,乙酸乙酯在饱和碳酸钠溶液中溶解度不大,所以可以用饱和碳酸钠溶液除去乙醇、乙酸,降低乙酸乙酯的溶解度;
故答案为:饱和碳酸钠溶液;中和乙酸、溶解乙醇、降低乙酸乙酯的溶解度;
(3)乙酸乙酯不溶于碳酸钠溶液,二者分层,用分液漏斗通过分液法分离;
故答案为:分液;
(4)乙醇与乙酸在浓硫酸做催化剂、吸水剂条件下反应生成乙酸乙酯和水,方程式:
CH3COOH+CH3CH2OH $?_{△}^{H_{2}SO_{4}(浓)}$CH3COOCH2CH3+H2O;
故答案为:CH3COOH+CH3CH2OH $?_{△}^{H_{2}SO_{4}(浓)}$CH3COOCH2CH3+H2O;
点评 本题考查了乙酸乙酯的制备,题目难度不大,涉及浓硫酸、饱和碳酸钠溶液的作用以及酯化反应的机理,试题培养了学生分析、理解能力及灵活应用所学知识解决实际问题的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 与H2SO4反应的铝粉7.2g | |
| B. | 参加反应的H2SO4为0.2mol | |
| C. | 铝与NaOH反应中消耗氧化剂约0.53mol | |
| D. | 参加反应的NaOH约为0.27mol |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:选择题
30ml 5mol/LNaOH溶液中NaOH的质量为
A.4g B.5g C.6g D.7g
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
一定条件下溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示。下列判断正确的是
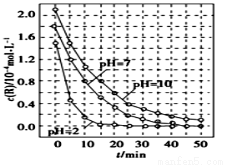
A.溶液酸性越强,R 的降解速 率越小
率越小
B.R的起始浓度越小,降解速率越大[
C.在0~50 min之间,pH=2和PH=7时R的降解百分率相等
D.在20~25 min之间,pH=10 时R的平均降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
已知分解1 mol H2O2 放出热量98KJ,在含少量I-的溶液中,H2O2的分解机理为:H2O2+I-→H2O +IO- 慢;H2O2+IO-→H2O+O2+I- 快,下列有关反应的说法正确的是
A.反应的速率与I-的浓度有关 B. IO-也是该反应的催化剂
C.反应活化能等于98KJ·mol-1 D.v(H2O2)=v(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
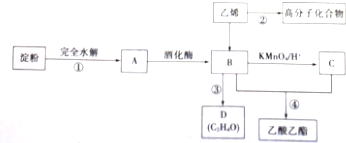
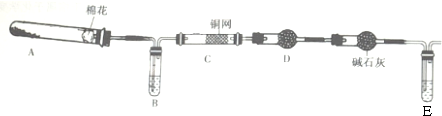
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com