
| A、纯碱不是碱 |
| B、食盐不是盐 |
| C、火碱不是碱 |
| D、干冰不是冰 |
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Cu2+、Mg2+、NH4+、Na+ |
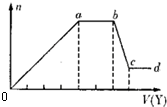 ①若Y是盐酸,则溶液中含有的金属阳离子是
①若Y是盐酸,则溶液中含有的金属阳离子是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
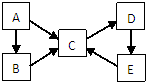 A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如下转化关系:
A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如下转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体硅是通信工程中制作光导纤维的主要原料,Na2SiO3常用来作木材防火剂. |
| B、漂白液是将氯气通入冷的消石灰[Ca(OH)2]中制得的,其有效成分为Ca(ClO)2 |
| C、酸雨是由于氮的氧化物和硫的氧化物的大量排放引起的,其中pH<5.6的为酸雨 |
| D、胃酸过多的病人可以服用氢氧化铝或者苏打来中和胃酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com