
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是( )
A.X的简单气态氢化物的热稳定性比W的弱
B.YX、ZX2、WX3中化学键的类型相同
C.W的最高价氧化物对应水化物的酸性比Z的弱
D.原子半径:rY >rZ >rW >rX
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源:2015-2016学年山东省高二6月月考化学试卷(解析版) 题型:选择题
某溶液中滴加一定量的BaCl2溶液产生白色沉淀,再加入硝酸,沉淀不溶解,这种溶液中
A.一定含SO42- B.一定含Ag+
C.可能含SO42- D.可能含CO32-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁葫芦岛一中等五校高二6月联考化学卷(解析版) 题型:选择题
固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s) NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g) H2(g)+I2(g)达到平衡时,c(H2)=0.5mol•L﹣1,c(HI)=3mol•L﹣1,则此温度下反应①的平衡常数为
H2(g)+I2(g)达到平衡时,c(H2)=0.5mol•L﹣1,c(HI)=3mol•L﹣1,则此温度下反应①的平衡常数为
A.12 B.16 C.20 D.25
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北沙市高一下第六次半月考化学卷(解析版) 题型:实验题
针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
活动一:查阅资料
NaNO2有毒,具有氧化性和还原性,NaNO2溶液显碱性,肉类在放置过程中,NaNO3逐渐转化为NaNO2,国家规定肉制品中NaNO2含量不能超过30 mg/kg。
活动二:鉴别NaNO2与食盐
(1)NaNO2与食盐的外观相似,易被当成食盐误用,分析以下两种鉴别方法:
① 能否各取少许固体用舌头品尝?_____。(选填“能”或“不能”)
② 用稀硫酸、淀粉和KI溶液鉴别,溶液变蓝的是NaNO2具有___性。
活动三:探究NaNO3与NaNO2的相互转化
(2)制取NaNO2与NaNO3混合溶液的装置如图所示。

已知:2NO2+2NaOH=NaNO2+NaNO3+H2O。
① 写出装置I中发生反应的化学方程式___________________________________。
② 水_______(选填“能"或“不能”)作为装置II中的试剂,理由是_________________。
③ 装置III中反应完全后,接下来的操作是_________________________________。
(3)将NaNO2与NaNO3混合溶液露置于空气,隔夜后,测得溶液的pH减小,则溶液中NaNO2的含量_______(选填“增多”、“减少"或“不变”),原因可能是______________(用化学方程式解释)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北沙市高一下第六次半月考化学卷(解析版) 题型:选择题
某有机物a的分子式和己烷相同,且主链上有4个碳原子,则下列关于a的观点正确的是( )
A.a分子中可能有三个甲基
B.a的一氯代物可能有三种
C.a的分子式为C6H10
D.a能与溴的四氯化碳溶液发生取代反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北沙市高一下第六次半月考化学卷(解析版) 题型:选择题
短周期元素W、X、Y、Z在元素周期表中的位置如图所示。下列说法正确的是( )

A.W的最高价氧化物对应的水化物是强酸
B.W的非金属性比Z的弱
C.Y的原子半径在同周期主族元素中最大
D.Z的气态氢化物的稳定性在同主族元素中最强
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高一6月月考化学试卷(解析版) 题型:选择题
某气态的烷烃与烯烃的混合气体9 g,其密度为同状况下H2密度的11.25倍,将混合气体通过足量的溴水,溴水增重4.2 g,则原混合气体的组成为
A.甲烷,乙烯 B.乙烷,乙烯
C.甲烷,丙烯 D.甲烷,丁烯
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三三模理综化学试卷(解析版) 题型:实验题
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
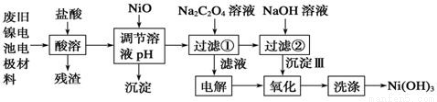
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4 >NiC2O4。 H2O > NiC2O4
H2O > NiC2O4 2H2O。
2H2O。
③ Ksp[Ni(OH)2]: 5.0×10-16 , Ksp(NiC2O4): 4.0×10-10。
认真研读题给信息,回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)电解过程中阴极反应式为: ,沉淀Ⅲ可被电解所得产物之一氧化,写出氧化反应的离子方程式: 。
(6)铁镍蓄电池,放电时总反应:Fe+Ni2O3+3H2O =Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是 。
A.电池的电解液为碱性溶液,电池的正极为Ni2O3,负极为Fe
B.电池充电时,阴极附近溶液的pH降低
C.电池放电时,负极反应为Fe+20H一一2e一
 Fe(OH)2
Fe(OH)2
D.电池充电时,阳极反应为2Ni(OH)2+20H一一2e一 Ni2O3+3 H2O
Ni2O3+3 H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安长安一中高二下第二次月考化学卷(解析版) 题型:选择题
已知如下反应:
 在水溶液中存在平衡:
在水溶液中存在平衡: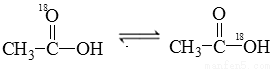 当
当 与 CH3CH2OH发生酯化反应时,不可能生成的产物是( )
与 CH3CH2OH发生酯化反应时,不可能生成的产物是( )
A. B.
B.
C. H2O  D. H218O
D. H218O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com