
常温下,下列各组离子在给定溶液中一定能大量共存的是
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.Kw=1.01×10-14的某无色溶液:NH4+、K+、AlO2-、Cl-
C.与铝反应产生大量氢气的溶液:Na+、Ba2+、HCO3-、NO3-
D.由水电离出来的c(H+)=1.0×10-13 mol·L-1的溶液:K+、Na+、NO3-、Cl-
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源:2014-2015广东省佛山市高一下学期第一次月考理化学试卷(解析版) 题型:选择题
Murad等三位教授最早提出NO分子在人体内有独特功能,近年来此领域研究有很大进展,因此这三位教授荣获1998年诺贝尔医学及生理学奖。关于NO的下列叙述中不正确的是
A、NO可以是某些含低价N物质氧化的产物 B、NO难溶于水
C、NO可以是某些含高价N物质还原的产物 D、NO是红棕色气体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高三下学期第二次质量检测理综化学试卷(解析版) 题型:选择题
下列离子反应方程式错误的是
A.向Na2SiO3溶液中逐滴加入少量稀盐酸:SiO32-+ 2H+=H2SiO3(胶体)
B.稀Fe(NO3)2溶液中加入稀盐酸:Fe2++4H++NO3-= Fe3++NO↑+2H2O
C.将Cu片加入稀硝酸中:3Cu + 8H++2NO3-=3Cu2+ +2NO↑+ 4H2O
D.向NH4Al(SO4)2溶液中加入过量的Ba(OH)2稀溶液:NH4+ + Al3+ + 2SO42- + 2Ba2+ + 5OH-=2BaSO4↓+ NH3·H2O + AlO2-+ 2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高三下学期第一次质量调查化学试卷(解析版) 题型:选择题
下列说法正确的是
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.已知酸性HF>CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:
[c(Na+)-c(F-)] < [c(K+)-c(CH3COO-)]
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省资阳市高三第三次模拟考试理综化学试卷(解析版) 题型:实验题
(16分)学习小组设计了如下图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:
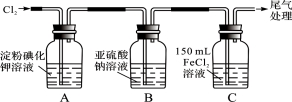
(1)通入氯气后,A中的现象是 。C装置中发生反应的离子方程式为: 。
(2)通入氯气一段时间后,B瓶的溶液中有一部分SO32-氧化成SO42-。计试验方案,检验B瓶溶液中Cl-和SO42-的存在。
实 验 步 骤 | 预期现象和结论 |
步骤1:取适量B瓶中溶液于一干净试管中,滴加 。 | 若产生白色沉淀,则B瓶溶液中存在SO42-。 |
| 产生白色沉淀。 |
步骤3:取步骤2后试管中的上层清液于一干净试管中,滴加0. 1 mol/L AgNO3溶液,振荡。 | 。 |
实验步骤2的目的是: 。
(3)为准确测定通入氯气一段时间后C瓶中剩余FeCl2的物质的量。实验如下:
①配制250 mL 溶液:将C瓶中全部溶液取出盛于250 mL容量瓶中,并准确配制成250 mL溶液。确保C瓶中的溶液全部取出(溶质无损失),需进行的操作是 。
②滴定:准确量取25.00 mL所配溶液于锥形瓶中,将0.20 mol/L KMnO4溶液装入 滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
(反应方程式: Fe2++MnO4-+H+ — Fe3++Mn2++H2O,未配平)
③计算:C瓶中剩余FeCl2的物质的量,n(FeCl2)= mol。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省渭南市高三教学质量检测(一模)化学试卷(解析版) 题型:实验题
(16分)(1)下图所示都是实验室中制取气体的装置,其中能实现随开随用,随关随停的是____________,其中仪器B的名称是____________。
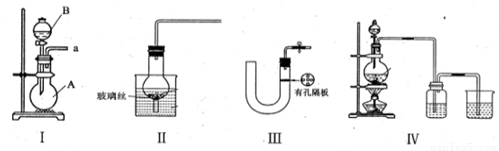
(2)请简述检验装置III的气密性的方法_________________________________.
(3)实验室利用铜和浓硫酸制取SO2,可选择上述气体发生装置的_________来实现。请写出其反应的化学方程式___________________________.
(4)若要用浓硫酸(质量分数为98%,密度为1.84g/mL)配制1 mol/L的稀硫酸500mL,则需要量取浓硫酸的体积为__________mL,所需的玻璃仪器有量筒、玻璃棒、烧杯、_________。
(5)①若在100 ml 18 mol/L浓硫酸中加入过最铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是__________________。
A.40.32 L B.30.24 L C.20.16 L D.13.44 L
②若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程_ 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省渭南市高三教学质量检测(一模)化学试卷(解析版) 题型:选择题
在含有4 mol HCI和1 mol MgSO4的混合溶液中逐摘加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如图,下列说法不正确的是
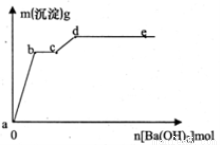
A.a→b时的沉淀的成分只有BaSO4
B.b→c时发生的离子反应为: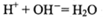
C.d点时加入的Ba(OH)2的物质的量为3mol
D.d点后溶液中离子的物质的量:Ba2+一定大于OH-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
(14分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l)  H1
H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l)  H2
H2
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)  H= 。(请用含有
H= 。(请用含有 H1、
H1、 H2的式子表示)
H2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
温度(K) | 平衡时NH3的物质的量(mol) |
T1 | 2.4 |
T2 | 2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
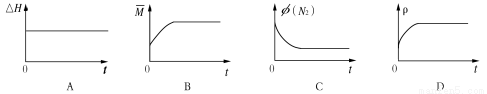
③下列图像分别代表焓变(H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。

①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500 mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量
为 g(假设溶液电解前后体积不变)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com