
| A. | 酸性氧化物:CO2、Mn2O7 | B. | 胶体:淀粉溶液、氯化铁溶液 | ||
| C. | 同素异形体:1H2O、D2O | D. | 碱式盐:Cu2(OH)2CO3、NaHCO3 |
分析 A.氧化物只有两种元素,且必须有氧元素,酸性氧化物是与碱反应生成盐和水的氧化物,溶于水一般生成酸的氧化物;
B.胶体的分散质微粒直径在1~100nm之间,是一种均一介稳定的分散系;
C.由同种元素形成的不同种单质互为同素异形体,互为同素异形体的物质要符合以下两个条件:同种元素形成,不同单质;
D.盐是指由金属离子和酸根离子组成的化合物,盐又分为正盐、酸式盐和碱式盐,酸式盐中还含有氢离子;碱式盐中还含有氢氧根离子.
解答 解:A.CO2、Mn2O7与碱反应都生成盐与水,所以都是酸性氧化物,故A正确;
B.淀粉溶液属于胶体、氯化铁溶液为溶液不属于胶体,故B错误;
C.同素异形体为单质,1H2O、D2O都为化合物,不是同素异形体,故C错误;
D.Cu2(OH)2CO3属于碱式盐,NaHCO3属于碳酸的酸式盐,故D错误;
故选A.
点评 本题考查物质的分类,掌握酸性氧化物、胶体、同素异形体、碱式盐等概念是解答的关键,题目难度不大.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题

| A. | ②④均能发生加成反应 | B. | ①⑥均能发生取代反应 | ||
| C. | ②③均能使酸性KMnO4溶液褪色 | D. | ④⑤均能与NaOH溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期.X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示.下列说法中正确的是( )
A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期.X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示.下列说法中正确的是( )| A. | 由A、B、E三种元素共同形成的化合物都含有共价键,水溶液都呈酸性 | |
| B. | C、D分别形成的简单离子的氧化性:C>D | |
| C. | 电解C、E形成的化合物水溶液可生成C、E对应的单质 | |
| D. | C元素所在周期中离子半径最小的是E元素形成的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
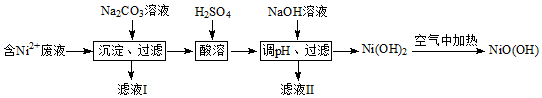
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
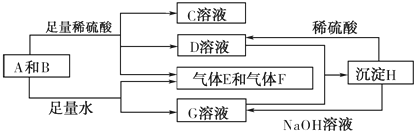
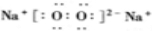 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g含有少量臭氧的氧气中,共含有氧原子数为2×6.02×1023 | |
| B. | 标准状况下,11.2 L四氯化碳含有的分子数为0.5×602×1023 | |
| C. | 5.6 g铁粉完全溶于硝酸,失去的电子数一定为0.3×6.02×1023 | |
| D. | 1 L0.5 mol/L Na2CO3 溶液中含有的CO32-数目为0.5×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol氢氧根离子与1 mol羟基所含电子数均为l0NA | |
| B. | 因为电负性O>N,所以H-O的键能比N-H的键能大,所以水的沸点高于氨气 | |
| C. | 标准状况下,22.4 L NH3分子含有的杂化轨道数为4NA | |
| D. | 1 mol SiO2晶体中含有Si-O键数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应都能设计成原电池 | |
| B. | 手机上用的锂离子电池属于一次电池 | |
| C. | 原电池中的阳离子向负极移动 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com