
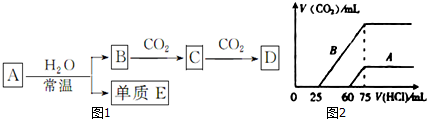
分析 (1)若A为金属钠,A与水反应生成单质E为H2,所以B为NaOH,则C为Na2CO3,D为NaHCO3;
(2)若A为过氧化钠,A与水反应生成单质E为O2,所以B为NaOH,则C为Na2CO3,D为NaHCO3;
(3)根据(1)(2)的分析答题;
(4)曲线A、B,开始没有气体,加入一定体积盐酸后生成气体,生成气体的反应为:HCO3-+H+=H2O+CO2↑,再结合反应OH-+H+=H2O、H++CO32-=HCO3-可知,若A中只有Na2CO3,开始发生CO32-+H+=HCO3-,前后两过程消耗HCl的体积相等,所以根据前后两过程消耗的盐酸的体积可判断溶液的组成,根据钠元素守恒可知,当加入75mL盐酸时,溶液中的溶质为氯化钠,所以原溶液中的氢氧化钠的物质的量 为0.1mol/L×0.075L=0.0075mol,据此计算氢氧化钠的物质的量浓度;曲线A生成二氧化碳消耗盐酸体积为(75-60)mL=15mL,曲线B生成二氧化碳消耗盐酸体积为(75-25)mL=50mL,由HCO3-+H+=H2O+CO2↑可求得两次实验通入的CO2的体积之比;
(5)根据等物质的量浓度的Na2CO3溶液和NaHCO3溶液的pH的大小判断溶液的碱性强弱.
解答 解:(1)若A为金属钠,A与水反应生成单质E为H2,所以B为NaOH,则C为Na2CO3,D为NaHCO3,A与水反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(2)若A为过氧化钠,A与水反应生成单质E为O2,所以B为NaOH,则C为Na2CO3,D为NaHCO3,A与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑,
故答案为:2Na+2H2O=2NaOH+H2↑;
(3)根据(1)(2)的分析可知,D为NaHCO3,
故答案为:NaHCO3;
(4)曲线A、B,开始没有气体,加入一定体积盐酸后生成气体,生成气体的反应为:HCO3-+H+=H2O+CO2↑,再结合反应OH-+H+=H2O、H++CO32-=HCO3-可知,若A中只有Na2CO3,开始发生CO32-+H+=HCO3-,前后两过程消耗HCl的体积相等,而实际开始阶段消耗盐酸体积大于产生二氧化碳消耗的盐酸体积,故A曲线表明M中的溶质为NaOH、Na2CO3,B曲线中,前后消耗盐酸的体积之比为1:3,则曲线B表明M中溶质为Na2CO3、NaHCO3,且二者物质的量之比为1:2,根据钠元素守恒可知,当加入75mL盐酸时,溶液中的溶质为氯化钠,所以原溶液中的氢氧化钠的物质的量 为0.1mol/L×0.075L=0.0075mol,所以氢氧化钠的物质的量浓度为$\frac{0.0075mol}{0.03L}$=0.25mol/L,曲线A生成二氧化碳消耗盐酸体积为(75-60)mL=15mL,曲线B生成二氧化碳消耗盐酸体积为(75-25)mL=50mL,由HCO3-+H+=H2O+CO2↑可知,则两次实验通入的CO2的体积之比=15mL:50mL=3:10,
故答案为:Na2CO3、NaHCO3;3:10;0.25mol/L.
(5)根据等物质的量浓度的Na2CO3溶液和NaHCO3溶液的pH的大小判断溶液的碱性强弱,具体操作为配制 0.1mol•L-1(或等物质的量浓度)的两种溶液,则其pH,Na2CO3溶液pH大于NaHCO3溶液,说明Na2CO3溶液碱性比NaHCO3溶液的碱性强,
故答案为:配制 0.1mol•L-1(或等物质的量浓度)的两种溶液,则其pH,Na2CO3溶液pH大于NaHCO3溶液,说明Na2CO3溶液碱性比NaHCO3溶液的碱性强.
点评 本题考查无机物推断、化学计算等,基本属于猜测验证型推断,需要学生熟练掌握元素化合物知识,(4)中计算关键是根据图象判断溶液溶质的成分,题目难度较大.


科目:高中化学 来源: 题型:多选题
| A. | CH2=CH2 | B. | CH3COOH | C. | CH2=CHClC=CH2 | D. | CH2=CHCH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫化亚铁溶于足量稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | 石灰石溶于醋酸:CaCO3+2CH3COOH═2CH3COO-+Ca2++CO2↑+H2O | |
| C. | FeCl2溶液中通入少量氯气:Fe2++Cl2═Fe3++2Cl- | |
| D. | 硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2═2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LBr2所含溴原子的数目为2NA | |
| B. | 常温下,NO2与足量的水反应生成0.1molNO,转移的电子数为0.2NA | |
| C. | 1 mol 乙醇中含有的C-H键的数目为6NA | |
| D. | 1mol•L-1的NaClO溶液中含有的ClO-数目小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中阴极和阳极的质量始终保持不变 | |
| B. | 溶液中的Cu2+、H+和Na+都要移向阴极,但在阴极优先放电的离子是Cu2+ | |
| C. | 溶液中的Cl-在阳极上完全放电后,溶液中的SO${\;}_{4}^{2-}$接着在该极上放电生成O2 | |
| D. | 电解过程中阴极上始终有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com