
| 反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热/kJ•mol-1 |
| A.1.0mol/L HCl溶液50mL、1.1mol/L NaOH溶液50mL | 13.0 | △H1 | |
| B.1.0mol/L HCl溶液50mL、1.1mol/L NH3•H2O溶液50mL | 13.0 | △H2 |
分析 ①甲根据A、B中酸与碱的元数、物质的量浓度、溶液体积都相同;乙根据弱电解质存在电离平衡,电离过程是吸热过程;
②结合Q=cm△t及物质的量与热量成正比计算.
解答 解:①甲认为A、B中酸与碱的元数、物质的量浓度、溶液体积都相同,则反应的热效应也相同;而乙认为NaOH是强碱,NH3•H2O是弱碱电离吸热,所以热效应不同;故答案为:A、B中酸与碱的元数、物质的量浓度、溶液体积都相同;NaOH是强碱,NH3•H2O是弱碱电离吸热;
②△H1=-$\frac{4.184×100×(19.8-13.0)}{1×0.05}$≈-56.9kJ/mol,故答案为:-56.9kJ/mol.
点评 本题考查了中和热的测定方法,题目难度不大,注意掌握测定中和热的正确方法,明确实验操作过程中关键在于尽可能减少热量散失,使测定结果更加准确.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
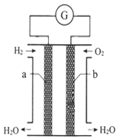 氢氧燃料电池是一种化学电源,如图所示,以石墨为电极,两极分别通入氢气和氧气,KOH溶液为电解质溶液,下列说法不正确的是( )
氢氧燃料电池是一种化学电源,如图所示,以石墨为电极,两极分别通入氢气和氧气,KOH溶液为电解质溶液,下列说法不正确的是( )| A. | 在电池反应中每转移2mol电子,正极消耗O2的体积为11.2L | |
| B. | b极的电极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 工作一段时间后,电解质溶液碱性减弱 | |
| D. | 该装置将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电解质溶液一定为强酸性 | |
| B. | 电子从a流出,经质子交换膜流向b | |
| C. | HS-在硫氧化菌作用下发生的反应为HS-+4H2O-8e-═SO42-+9H+ | |
| D. | 若该电池电路中有0.8mol电子发生转移,则有0.9molH+通过质子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C(石墨,s)=C(金刚石,s)△H>0 则金刚石比石墨稳定 | |
| B. | 已知2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol 则H2的燃烧热为285.8 kJ/mol | |
| C. | 已知2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol 则C(碳)的燃烧热为110.5 kJ/mol | |
| D. | 已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6 kJ/mol 则该反应的中和热为114.6 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤法 | B. | 结晶法 | C. | 蒸馏法 | D. | 沉淀法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 莽草酸是一种合成治疗甲型H1N1流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中,下列关于这两种有机化合物的说法正确的是( )
莽草酸是一种合成治疗甲型H1N1流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中,下列关于这两种有机化合物的说法正确的是( )| A. | 两种酸都能与溴水反应 | |
| B. | 两种酸遇三氯化铁溶液都显色 | |
| C. | 鞣酸分子与莽草酸分子相比多了两个碳碳双键 | |
| D. | 等物质的量的两种酸能消耗等量的NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com