
【题目】硫的化合物在化工生产、污水处理等领域应用广泛。
Ⅰ.羰基硫(O=C=S)广泛存在于以煤为原料制备的各种化工原料气中,能引起催化剂中毒、大气污染等。羰基硫的水解和氢解是两种常用的脱硫方法,其反应式分别为:
a.水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H1=-35 kJ/mol
H2S(g)+CO2(g) △H1=-35 kJ/mol
b.氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) △H2
H2S(g)+CO(g) △H2
已知:CO(g)+H2O(g)![]() H2(g)+CO2(g) △H3=-42kJ/mol
H2(g)+CO2(g) △H3=-42kJ/mol
(1)完成上述氢解反应的热化学方程式:______。
(2)一定条件下,密闭容器中发生反应a,其中COS(g)的平衡转化率(α)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是______(填字母)。

(3)反应b的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示正反应的平衡常数(K正)的是______(填“A”或“B”)。

(4)T1℃时,向容积为10L的恒容密闭容器中充入2molCOS(g)和2molH2(g),发生反应b,则:COS的平衡转化率为______。
Ⅱ.矿石冶炼与含硫化合物有关。
(5)将冰铜矿(主要为Cu2S和FeS相熔合而成)加熔剂(石英砂)在1200℃左右吹入空气进行吹炼:Cu2S被氧化为Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程中发生反应的化学方程式分别是:___________;___________。
(6)废气中的SO2可用NaOH溶液吸收,吸收SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液仍呈强碱性。
①吸收Cl2后的溶液中一定存在的阴离子有OH-、______。
②吸收Cl2后的溶液中可能存在SO32-,取该溶液于试管中,滴加黄色的溴水,得到无色溶液。此实验不能证明溶液中含有SO32-,理由是___________。
【答案】COS(g)+H2(g)![]() H2S(g)+CO(g)△H=+7kJ/mol ABC A 50% 2Cu2S+3O2
H2S(g)+CO(g)△H=+7kJ/mol ABC A 50% 2Cu2S+3O2![]() 2Cu2O+2SO2 2Cu2O+Cu2S
2Cu2O+2SO2 2Cu2O+Cu2S![]() 6Cu+2SO2↑ SO42-、Cl- NaOH溶液能跟溴单质反应,使溶液呈无色
6Cu+2SO2↑ SO42-、Cl- NaOH溶液能跟溴单质反应,使溶液呈无色
【解析】
(1)根据盖斯定律,将①-②,整理可得相应反应的热化学方程式;
(2)化学方程式中相应物质的计量数的比等于物质的反应速率比;
(3)该反应的正反应是吸热反应,则逆反应是放热反应,升高温度平衡正向移动,导致正反应平衡常数增大;
(4)T1℃时,正逆平衡常数相等,正逆反应平衡常数互为倒数,则该温度下正逆反应平衡常数为1,开始时c(H2)=c(COS)=![]() =0.2mol/L,设COS的平衡转化率为x,
=0.2mol/L,设COS的平衡转化率为x,
可逆反应 COS(g) + H2(g)![]() H2S(g) + CO(g)
H2S(g) + CO(g)
开始(mol/L)0.2 0.2 0 0
反应(mol/L)0.2x 0.2x 0.2x 0.2x
平衡(mol/L)0.2-0.2x 0.2-0.2x 0.2x 0.2x
化学平衡常数K=![]() =1据此计算x;
=1据此计算x;
(5)Cu2S被氧化为Cu2O:2Cu2S+3O2 ![]() 2Cu2O+2SO2;Cu2O与Cu2S反应:2Cu2O+Cu2S
2Cu2O+2SO2;Cu2O与Cu2S反应:2Cu2O+Cu2S![]() 6Cu+2SO2↑;
6Cu+2SO2↑;
(6)氯气具有强氧化性,SO32-中+4价的硫具有还原性,氯气与SO32-会发生氧化还原反应;溶液显碱性时能与溴水反应,不能确定溴水与SO32-会发生氧化还原反应。
(1)①COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H1=-35 kJ/mol
H2S(g)+CO2(g) △H1=-35 kJ/mol
②CO(g)+H2O(g)![]() H2(g)+CO2(g) △H3=-42kJ/mol
H2(g)+CO2(g) △H3=-42kJ/mol
将方程式①-②整理可得COS(g)+H2(g)![]() H2S(g)+CO(g) △H2=+7kJ/mol;
H2S(g)+CO(g) △H2=+7kJ/mol;
(2)根据方程式COS(g)+H2(g)![]() H2S(g)+CO(g)可知,COS和H2S的化学计量数相等,则二者化学反应速率相等,与反应是否达到平衡状态无关,也与反应温度无关,故合理选项是ABC;
H2S(g)+CO(g)可知,COS和H2S的化学计量数相等,则二者化学反应速率相等,与反应是否达到平衡状态无关,也与反应温度无关,故合理选项是ABC;
(3)该反应的正反应是吸热反应,则逆反应是放热反应,升高温度平衡正向移动,导致正反应平衡常数增大,
故选A;
(4)T1℃时,正逆平衡常数相等,正逆反应平衡常数互为导致,则该温度下正逆反应平衡常数为1,
开始时c(H2)=c(COS)=![]() =0.2mol/L,设COS的平衡转化率为x,
=0.2mol/L,设COS的平衡转化率为x,
可逆反应 COS(g) + H2(g)![]() H2S(g) + CO(g)
H2S(g) + CO(g)
开始(mol/L)0.2 0.2 0 0
平衡(mol/L)0.2-0.2x 0.2-0.2x 0.2x 0.2x
化学平衡常数K=![]() =1,解得x=0.5=50%;
=1,解得x=0.5=50%;
(5)Cu2S被氧化为Cu2O:2Cu2S+3O2 ![]() 2Cu2O+2SO2;Cu2O与Cu2S反应:2Cu2O+Cu2S
2Cu2O+2SO2;Cu2O与Cu2S反应:2Cu2O+Cu2S![]() 6Cu+2SO2↑;
6Cu+2SO2↑;
(6)①吸收SO2后的碱性溶液还可用于Cl2的尾气处理,亚硫酸钠与氯气发生氧化还原反应生成硫酸钠和盐酸,则吸收Cl2后的溶液中一定存在的阴离子有OH-、SO42-、Cl-;
②滴加黄色的溴水,得到无色溶液,此实验不能证明溶液中含有SO32-,理由是NaOH溶液能跟溴单质反应,使溶液呈无色。


科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)置于一恒容密闭容器中,在不同温度下进行反应(已知该反应为放热反应)。实验记录得到下表中的两组数据:下列有关说法中不正确的是( )
实验序号 | 温度(℃) | 平衡常数(L/mol) | 起始量/mol | 平衡量/mol | 达到平衡所需时间(min) | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
A. 表中x=1.6;y=0.2B. 表中t>6
C. 表中K1、K2的关系:K2>K1D. 实验1在前6min的反应速率υ(SO2)=0.2mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在周期表中的相对位置如下表所示,下面判断不正确的是( )
甲 | 乙 | |
丙 | 丁 | 戊 |
A. 金属性:甲<丙
B. 最高价氧化物对应的水化物的碱性:丙>丁>戊
C. 原子半径:丁>丙>甲
D. 最外层电子数:乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10 mL pH =1的CH3COOH 溶液加水稀释至100 mL后,溶液的pH为
A. 2 B. 2<pH<7 C. 1<pH<2 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿[主要成分为Co2O3和Co(OH)3,还有少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如图所示:
 已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式__________________________。
(2)NaClO3的作用是___________________________________。
(3)加Na2CO3调pH至5.2所得沉淀为____________________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。萃取剂的作用是_____;其使用的适宜pH范围是_____(填字母)。

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
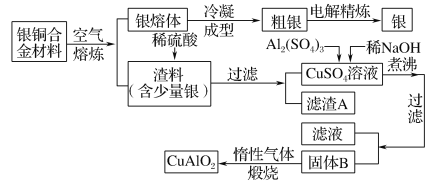
[注:Al(OH)3和Cu(OH)2开始分解的温度分别为450 ℃和80 ℃]
(1)电解精炼银时,阴极反应式为___________________________。
滤渣A与稀硝酸反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为________________________。
(2)固体混合物B的组成为________;
(3)完成煅烧过程中一个反应的化学方程式:__
________CuO+________Al2O3![]() ________CuAlO2+________。
________CuAlO2+________。
(4)CuSO4溶液也可用于制备胆矾,其基本操作是____________、过滤、洗涤和干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂( LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(由Al箔、 LiFePO4活性材料、少量不溶于酸碱的导电剂组成)中的资源,部分流程如图:

已知:Ksp(Li2CO3)=1.6×10-3。部分物质的溶解度(S)如下表所示:

(1)写出碱溶时Al箔溶解的离子方程式:______________________。
(2)为提高酸浸的浸出率,除粉碎、挑拌、升温外,还可采用的方法有_________________________________。
(3)酸浸时产生标况下3.36LNO时,溶解 LiFePO4_________mol(其他杂质不与HNO3反应)。
(4)若滤液②中c(Li+)=4mol·L-1,加入等体积的Na2CO3后,Li+的沉降率达到90%,计算滤液③中c(CO32-)=___________mol/L。
(5)流程中用“热水洗涤”的原因是____________________________________________。
(6)工业上将回收的Li2CO3、FePO4粉碎与炭黑混合高温灼烧再生制备 LiFePO4,写出反应的化学方程式:_________________________________;若测得产品中n(Li)︰n(Fe)︰n(P)=1︰0.9︰1,则产品中n(Fe2+)/n(Fe3+)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于放热反应的是
A. C + CO2![]() 2CO
2CO
B. CaCO3![]() CaO + CO2↑
CaO + CO2↑
C. 2Al + Fe2O3![]() 2Fe + Al2O3
2Fe + Al2O3
D. Ba(OH)2·8H2O + 2NH4Cl=BaCl2 + 2NH3↑+ 10H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com