
以铁为阳极,以铜为阴极,对足量的NaOH溶液进行电解。一段时间后得到2molFe(OH)3沉淀,此间共消耗的水的物质的量为
A.2mol B.3mol C.4mol D.5mol
D
【解析】
试题分析:根据铁原子守恒知,2molFe(OH)3→2molFe(OH)2,所以生成2molFe(OH)3需要2molFe(OH)2;
活泼金属铁作电解池阳极时,电解氢氧化钠溶液的电解方程式为Fe+2H2O H2+Fe(OH)2↓,
H2+Fe(OH)2↓,
根据电解方程式得,生成2molFe(OH)2需要水的物质的量为4mol;
又氢氧化亚铁不稳定,能被氧气氧化成氢氧化铁沉淀,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
根据方程式得,生成2molFe(OH)3需要水的物质的量为1mol,
所以得到2molFe(OH)3沉淀消耗水的物质的量共为5mol.故选D。
考点:电解池
点评:电解池是历年高考常考知识点,注重考查学生分析问题、解决问题的能力。近年来常以新型电解池进行考查。


科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第8讲 电化学基础练习卷(解析版) 题型:填空题
(1)如图1是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。
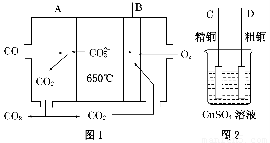
回答下列问题:
①写出A极发生的电极反应式______________________________________。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应与________极相连(填“C”或“D”)。
③当消耗标准状况下2.24 L CO时,C电极的质量变化为________。
(2)工业上,可用铁作阳极,电解KOH溶液制备K2FeO4。
①电解过程中,OH-向________(填“阴”或“阳”)极移动,阳极的电极反应式为____________________________。
②若阳极有28 g Fe溶解,则阴极析出的气体在标准状况下的体积为________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com