
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了如图所示装置进行有关实验:

(1)先关闭活塞a,将6.4g铜片和10mL18mol/L的浓硫酸放在圆底烧瓶中共热至反应完成,发现烧瓶中还有铜片剩余.再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中圆底烧瓶内发生反应的化学方程式:打开活塞a之前______________;打开活塞a之后______________;
②B是用来收集实验中产生的气体的装置,但集气瓶内的导管未画全,请直接在图上把导管补充完整______________;
(2)实际上,在打开活塞a之前硫酸仍有剩余.为定量测定余酸的物质的量,甲、乙两学生进行了如下设计:
①甲学生设计的方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量.他测定SO2的方法是将装置A产生的气体缓缓通过装置D,从而测出装置A产生气体的体积(已折算成标准状况下)。你认为甲学生设计的实验方案中D装置中的试剂为______________(填化学式);
②乙学生设计的方案是:将反应后的溶液冷却后全部移入到烧杯中稀释,并按正确操作配制100mL溶液,再取20mL于锥形瓶中,用______________作指示剂,用标准氢氧化钠溶液进行滴定[已知:Cu(OH)2开始沉淀的pH约为5],选择该指示剂的理由为______________;再求出余酸的物质的量,若耗去amol/L氢氧化钠溶液bmL,则原余酸的物质的量为______________mol(用含a、b的表达式来表示)。
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 2Cu+2H2SO4+O2=2CuSO4+2H2O
CuSO4+SO2↑+2H2O 2Cu+2H2SO4+O2=2CuSO4+2H2O 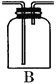 饱和NaHSO3 甲基橙 Cu(OH)2开始沉淀的pH约为5,若用酚酞作指示剂时溶液中的Cu2+会和NaOH反应,Cu(OH)2的蓝色会干扰滴定终点的正确判断
饱和NaHSO3 甲基橙 Cu(OH)2开始沉淀的pH约为5,若用酚酞作指示剂时溶液中的Cu2+会和NaOH反应,Cu(OH)2的蓝色会干扰滴定终点的正确判断 ![]()
【解析】
(1)打开活塞a之前,浓硫酸和Cu在加热条件下发生氧化还原反应生成CuSO4、SO2和H2O,反应后,硫酸变成稀硫酸,与铜不反应,再打开活塞a后,Cu、O2和稀硫酸反应生成CuSO4和H2O,结合二氧化硫的密度分析解答;
(2)①用D装置测定SO2的体积必须做到不能在测量时损耗二氧化硫,据此分析解答;②由于Cu(OH)2开始沉淀的pH约为5,因此滴定操作应选择变色范围接近pH=5的指示剂,且不能生成Cu(OH)2,否则会干扰滴定终点的判断;再根据H2SO4+2NaOH=Na2SO4+2H2O计算原余酸的物质的量。
(1)①打开活塞a之前,浓硫酸和Cu在加热条件下发生氧化还原反应生成CuSO4、SO2和H2O,反应的化学方程式为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;打开活塞a后,Cu、O2和稀硫酸反应生成CuSO4和H2O,反应的化学方程式为2Cu+2H2SO4+O2=2CuSO4+2H2O,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;打开活塞a后,Cu、O2和稀硫酸反应生成CuSO4和H2O,反应的化学方程式为2Cu+2H2SO4+O2=2CuSO4+2H2O,故答案为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;2Cu+2H2SO4+O2=2CuSO4+2H2O;
CuSO4+SO2↑+2H2O;2Cu+2H2SO4+O2=2CuSO4+2H2O;
②铜跟浓硫酸反应生成了二氧化硫气体,二氧化硫的密度比空气大,可以用向上排气法收集,所以装置中的导气管应长进短出,装置图为 ,故答案为:
,故答案为: ;
;
(2)①测定SO2的量必须准确测定无气体损耗,甲用排水法测定装置A产生气体的体积,实验方案中D装置中的试剂应该与二氧化硫不反应,且二氧化硫在其中溶解度较小,二氧化硫在饱和NaHSO3溶液中的溶解度较小,所以可用排饱和NaHSO3溶液的方法测出装置A产生气体的体积,故答案为:饱和NaHSO3;
②由于Cu(OH)2开始沉淀的pH约为5,因此滴定操作应选择变色范围接近pH=5的指示剂,以减小滴定误差,故选择甲基橙作指示剂,若用酚酞作指示剂时溶液中的Cu 2+会和NaOH反应,Cu(OH)2的蓝色会干扰滴定终点的正确判断;设余酸的物质的量为n,消耗NaOH的物质的量为:a mol/L×b×10-3 L=ab×10-3 mol,根据H2SO4+2NaOH=Na2SO4+2H2O可知滴定过程中消耗H2SO4的物质的量=![]() ×ab×10-3 mol,因此原余酸的物质的量为
×ab×10-3 mol,因此原余酸的物质的量为![]() ×ab×10-3 mol×
×ab×10-3 mol×![]() =
=![]() ×ab×10-3 mol,故答案为:甲基橙;Cu(OH)2开始沉淀的pH约为5,若用酚酞作指示剂时溶液中的Cu2+会和NaOH反应,
×ab×10-3 mol,故答案为:甲基橙;Cu(OH)2开始沉淀的pH约为5,若用酚酞作指示剂时溶液中的Cu2+会和NaOH反应,![]() ×ab×10-3。
×ab×10-3。


科目:高中化学 来源: 题型:
【题目】把小块木炭在酒精灯上烧至红热,迅速投入热的浓硝酸中,发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧发出光亮。
(1)写出红热木炭被热的浓硝酸氧化为CO2的化学方程式_________。
(2)木炭与浓硝酸反应过程中还伴随着浓硝酸的分解,除了产生氧气外,也产生红棕色气体。相同条件下该分解反应产生的氧气与红棕色气体的体积之比为_________。
(3)某研究性学习小组的同学对“木炭在液面上迅速燃烧发出光亮”的原因做出3个猜想:
猜想一:甲同学认为空气中O2支持木炭燃烧
猜想二:乙同学认为浓硝酸分解产生的O2支持木炭燃烧
猜想三:丙同学认为反应产生的NO2支持木炭燃烧
①根据木炭在空气中燃烧的现象,甲同学的猜想明显不合理,理由是_________。
②理论分析乙同学的猜想也不正确,原因是_________。
③要证实丙同学的猜想,还需补充的实验方案是_________(请写出实验操作、现象和结论)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、HCN与K2CO3在一定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为________。
(2)配合物K4Fe(CN)6的中心离子的价电子排布图为______,该中心离子的配位数是_______。
(3)1mol HCN分子中含有σ键的数目为_______,HCN分子中碳原子轨道杂化类型是_______,与CN-互为等电子体的阴离子是_______。
(4)K2CO3中阴离子的空间构型为_________,其中碳原子的价层电子对数为____________。
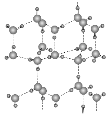
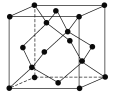
(5)冰的晶体结构模型如图,它的晶胞与金刚石相似,水分子之间以氢键相连接,在一个晶胞中有________个氢键,若氢键键长为d nm,则晶体密度(g·cm-3)计算式为_______ (用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢(H2O2)在医药、化工、民用等方面有广泛的应用。回答下面问题:
(1)最早制备H2O2使用的原料是易溶于水的BaO2和稀硫酸,发生反应的化学方程式是_____。BaO2的电子式为:__________。
(2)目前工业制备H2O2的主要方法是蒽醌法。反应流程如下:
![]()
已知:乙基蒽醌是反应中的催化剂。
①蒽醌法所用原料的物质的量之比为_____________。
②操作a是__________________。
③再生回收液的成分是______________________。
(3)测量过氧化氢浓度常用的方法是滴定法,某次测定时,取20. 00mL过氧化氢样品,加入过量硫酸酸化,用0. l000mol/L的KMnO4标准溶液滴定至终点,消耗10. 00mL,滴定时发生反应的离子方程式为____,该样品中H2O2的物质的量浓度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜是由铜和锌组成的合金,在黄铜中加入镍可显著提高黄铜在大气中和海水中的耐蚀性。回答下列问题:
(1)基态Ni2+的核外电子排布式为____________________,有_______个未成对电子。
(2)CuSO4溶液里逐滴滴入过量氨水,形成深蓝色溶液。
①深蓝色的溶液 是因为生成了一种配离子,其离子符号为____________________
其中配位原子是____________ 。
②NH3分子的空间构型是_______。NH3的键角______(填大于或小于)H2O,原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒奶粉主要是奶粉中含有有毒的三聚氰胺(结构如图)。
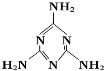
下列关于三聚氰胺分子的说法中正确的是( )
A. 一个三聚氰胺分子中共含有15个σ键
B. 所有氮原子均采取sp3杂化
C. 属于极性分子
D. 三聚氰胺分子中同时含有极性键和非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)![]() 0.1 mol/L
0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2NO2N2O4(g) H<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是
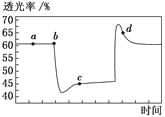
A.b 点的操作是压缩注射器
B.c 点与a点相比,c(NO2)增大、c(N2O4)减小
C.d 点:υ(正)<υ(逆)
D.若在c点将温度降低,其透光率将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是 ( )
A. 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O
B. 少量SO2通入氢氧化钠溶液中:OH-+SO2=HSO3-
C. 加热可增强纯碱溶液去污能力:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. 用惰性电极电解CuSO4溶液: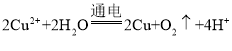
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com