
����Ŀ���±���Ԫ�����ڱ���һ���֣����ݱ��и�����10��Ԫ�أ��ش��������⡣
| ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
2 | C | N | O | F | ||||
3 | Na | Mg | Al | S | Cl | Ar |
(1)�ǽ�������ǿ��Ԫ���� ��
(2)��ѧ��������õĵ����� ��
(3)C��O�У�ԭ�Ӱ뾶�ϴ���� ��
(4)ij���ӵĽṹʾ��ͼΪ![]() �������ӵķ���Ϊ__________��
�������ӵķ���Ϊ__________��
(5)����������Ҫ������ֱ�ΪSO2�� (�ѧʽ)��
(6)H2S��HCl�У����ȶ��Խ�ǿ���� ��
(7)NaOH��Mg(OH)2��Al(OH)3�У�������ǿ���� ��������������������� ��
(8)����һ����̬�⻯��ķ������ģ����ͼ��ʾ��д�����Ļ�ѧʽ ����ˮ��Һ�� (��������������������)�����⻯����NԪ�غ�HԪ�ص�������m(N)��m(H)= ��
(���ԭ��������Nһ14 H��1)

���𰸡���1��F��2��Ar��3��C
��4��Mg2+��5��SO3��6��HCl
��7��NaOH Al(OH)3
��8��NH3 ���� 14:3
�����������������
(1)���и�����10��Ԫ�أ�F�ķǽ�������ǿ��
(2)��ѧ��������õĵ�����ϡ������Ar��Ҳ��Ϊ�������壻
(3)C��Oλ��ͬ���ڣ�ͬ����Ԫ�ش�ǰ����ԭ�Ӱ뾶��С����ԭ�Ӱ뾶�ϴ����C��
(4)�����ӵĺ˵����Ϊ12��ΪMgԪ�أ������ӵķ���ΪMg2+��
(5)����������Ҫ������ֱ�ΪSO2��SO3��
(6)�ǽ�����Խǿ���⻯��Խ�ȶ�����H2S��HCl�У����ȶ��Խ�ǿ����HCl��
(7)������Խǿ������������Ӧ��ˮ�������Խǿ����NaOH��Mg(OH)2��Al(OH)3�У�������ǿ����NaOH���������������������Al(OH)3��
(8)���ݷ������ģ�Ϳ�֪������̬�⻯��Ļ�ѧʽΪNH3����ˮ��Һ�Լ��ԣ����⻯����NԪ�غ�HԪ�ص�������m(N)��m(H) =14:3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ѧ�ҳ������ȼ���ֱ�Ӳⶨijһ��Ӧ�ķ�Ӧ�ȣ��ֲ�ã�CH3OH��g��+ 3/2O2��g��=CO2��g��+2H2O��g����H=-192.9kJ/mol����֪H2O��l��=H2O��g����H=+44kJ/mol����д��32g CH3OH��g����ȫȼ������Һ̬ˮ���Ȼ�ѧ����ʽ ________________________________________________
��2����֪C(s)+O2(g)=CO2(g) ��H1��-393.5kJ/mol�� 2CO(g)+O2(g)=2CO2(g) ��H2����566.0kJ/mol��C(s)+0.5O2(g)=CO(g) ��H3��akJ/mol����a=__________
��3����֪N2(g) +3H2(g) ![]() 2NH3(g)1��0.5 N2(g)+1.5H2(g)
2NH3(g)1��0.5 N2(g)+1.5H2(g) ![]() NH3(g) ��NH3(g)
NH3(g) ��NH3(g) ![]() 0.5 N2(g)+1.5H2(g) ��ƽ�ⳣ���ֱ�Ϊk1��K2��K3��д��K1��K2�Ĺ�ϵʽ_______��д��K2��K3�Ĺ�ϵʽ________
0.5 N2(g)+1.5H2(g) ��ƽ�ⳣ���ֱ�Ϊk1��K2��K3��д��K1��K2�Ĺ�ϵʽ_______��д��K2��K3�Ĺ�ϵʽ________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ά����C��ʹ���۩�����Һ��ɫ�����ʣ�ͨ��ʵ�飨��ͼ��ʾ���Ƚϼ���ƻ��֭�ͳ�֭�Ķ�����ȷ��������ά����C�����Ķ��٣�Ҫ�ó���ȷ���ۣ���ʵ��ʱ��Ҫ���Ƶ������ǣ� ��

A.ʵ��ʱ���������ձ���ͬʱ�μ�Һ��
B.���۩�����Һ�������Ũ�ȱ������
C.��ͷ�ιܵγ��Ĺ�֭�ĵ����������
D.��ͷ�ιܵγ���ÿ�ι�֭������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ⱦ����Խ��Խ�ܵ����ǵĹ�ע����ɻ�����Ⱦ����Ҫԭ��������������������й����ŷ��й���������ġ����л�������������Ӧ�����ʲ���ص���
A. ����ЧӦ����CO2 B. ��ɫ��Ⱦ������������
C. ���ꡪ��SO2 D. ����������ʯȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ���к������Ľ���Ԫ�غͷǽ���Ԫ���γɵ��ȶ��������ǣ� ��
A.Al2O3
B.SiO2
C.Fe2O2
D.CaO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£��ܱ������з�����ӦM(g)![]() N(g),��Ӧ�����е������仯��ͼ������1��ʾ������˵���������
N(g),��Ӧ�����е������仯��ͼ������1��ʾ������˵���������

A. �÷�Ӧ����Ӧ���Ϊ(E3-E2)kJmol-1
B. �÷�Ӧ�ķ�Ӧ��Ϊ(E1-E2) kJmol-1
C. ����II��ʾ�����������䣬�����¶�ʱ�������仯
D. ����III��ʾ�����������䣬�������ʱ�������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ�������
A.�����DZ��Ƹ�����õķ��ͷ۵���Ҫ�ɷ�֮һ
B.��������ڽ�����ʯ�Ĵ����ͽ������ϵı�����ϴ
C.��ԭ���ۿ�����ʳƷ���ڵĿ�������
D.�������׳Ƹ��ͣ���ʪ��ǿ�������ڻ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijЩװ�β��ϻỺ���ͷų�ij�ֻ�ѧ���ʣ�Ӱ�콡�������ֻ�ѧ���ʿ�����
A.��ȩB.O2C.N2D.CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�N2O�ֽ�IJ���ʵ���������£� ��
��Ӧʱ��/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c��N2O��/molL-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
��ͼ����ȷ��ʾ�÷�Ӧ�й��������仯���ɵ��ǣ� ��
��ע��ͼ�а�˥��ָ��һŨ��N2O����һ��ʱ�������Ӧʱ�䣬c1��c2����ʾN2O��ʼŨ����c1��c2��
A��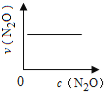 B��
B�� C��
C�� D��
D��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com