
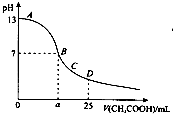
 常温下,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,下列有关离子浓度关系的比较,正确的是( )
常温下,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,下列有关离子浓度关系的比较,正确的是( )| A、在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B、在B点a>12.5,且有:c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| C、在C点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| D、在D点:c(CH3COO-)+c(CH3COOH)=2 c(Na+) |


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
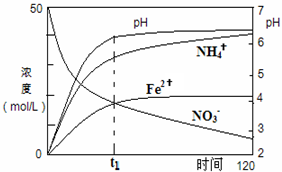 氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.
氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | --- | -3 | -2 | |
| A、元素X和Q形成的化合物中不可能含有共价键 |
| B、X、Y、M的单质分别与水反应,Y最剧烈 |
| C、X、Z、R的最高价氧化物的水化物之间可两两相互反应 |
| D、Y的氧化物水化物的酸性一定强于R的氧化物水化物的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶液 | 加入物质 | 答案序号 |
| (1)氯化铝溶液 | 加入过量氨水 | |
| (2)饱和石灰水 | 通入过量CO2气体 | |
| (3)含少量NaOH的偏铝酸钠溶液 | 通入过量CO2气体 | |
| (4)含少量盐酸的氯化铝溶液 | 逐滴加入NaOH溶液 | |
| (5)MgCl2、AlCl3的混合液 | 逐滴加入NaOH溶液至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| c(Pb2+) |
| c(NO3-) |
| 1 |
| 2 |
| c(Pb2+) |
| c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
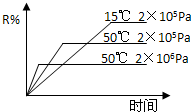 在密闭容器中进行下列反应:M(g)+N(g)?R(g)+2X,该反应中R的体积分数如图所示,下列情况正确的是( )
在密闭容器中进行下列反应:M(g)+N(g)?R(g)+2X,该反应中R的体积分数如图所示,下列情况正确的是( )| A、正反应为吸热反应,X为气体 |
| B、正反应为吸热反应,X为固体或液体 |
| C、正反应为放热反应,X为气体 |
| D、正反应为放热反应,X为固体或液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用A表示的反应速率是0.8 mol?L-1?s-1 |
| B、分别用B、C、D表示反应的速率,其比值是3:2:1 |
| C、在2 min末时的反应速率,用反应物B来表示是0.3 mol?L-1?min-1 |
| D、在这2 min内用B和C表示的反应速率的值都是相同的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com